مرحبا بك في هذا المنتدى !
يبدو أنك جديد هنا. إذا كنت تريد أن تتورط، انقر فوق أحد هذه الأزرار!
روابط سريعة
الأقسام
- 9.5K جميع الأقسام
- العلوم الطبية الأساسية Basic Medical Sciences
- علم التشريح العام و الجنين Anatomy and Embryology
- علم وظائف الأعضاء (الفيزيولوجيا) Physiology
- علم النسج Histology
- علم النسج العام ( عدا الأسنان ) General Histology
- علم النسج الخاص بالأسنان Oral histology
- علم الخليةو الحياة Biology
- علم التشريح المرضي Pathology
- التشريح المرضي العام ( عدا الأسنان ) Pathology
- التشريح المرضي الخاص بالأسنان Oral Pathology
- علم الأحياء الدقيقة Microbiology
- الجراثيم و الفيروسات Germs and Viruses
- الطفيليات الطبية Parasitology
- الفطور و الحشرات Insects and Fungi
- علم الوراثة الطبية Medical Genetics
- علم المناعة الطبية Medical Immunology
- 4 العلوم الطبية السريرية Clinical Medical Sciences
- الأمراض الداخلية Internal Medicine
- 4 الجراحة Surgery
- التوليد و الأمراض النسائية Gynacology & Obstetrics
- الصحة الجنسية Sexual Health
- طب الأطفال Pediatrics
- الجلدية Dermatology
- العينية Ophthalamology
- انف و أذن و حنجرة Ear, Nose, and Throat
- الطب المخبري labratory Medicine
- علم الأورام Oncology
- الطب الشرعي Forensic Medicine
- الطب النفسي Psychiatric
- التغذية والطب البديل Nourishments and Alternative Medicine
- طب الطوارئ و الإسعافات الأولية Emergency Medicine And Primary aids
- متلازمات طبية Medical Syndromes
- علم الأشعة Radiology
- طب الأسنان Dental Medicine
- التعويضات المتحركة الكاملة و الجزئية Removable Prothodontics
- المداواة الترميمية operative dentistry
- المداواة اللبية Endodontics
- طب أسنان الأطفال Pediatric Dental
- جراحة الوجه والفكينoral surgery
- التعويضات الثابتة Fixed Prothodontics
- المواد السنية dental materials
- النسج حول السنية periodontology
- التقويم Orthodontics
- منتدى فنيي الأسنان dental technicians
- طب الفم العام general oral medicine
- علم الأشعة Radiology
- حالات سريريةClinical Cases
- أخر مستجدات طب الأسنان last news
- المنتدى الطبي السني العامgeneral dentistry
- علم الصيدلة Pharma
- علم الأدوية
- علم الأدوية Pharmacology
- أدوية الطوارئ Emergency drugs
- المضادات الحيوية Antibiotics
- الأدوبة المسببة للتشوهات الجنينية Teratogenic drugs
- أدوية Drugs
- علم الكيمياء Chemistry
- كيمياء حيوية سريرية Clinical Biochemistry
- الكيمياء العامة و العضوية و الفيزيائية General & organic chemistry & physical
- الكيمياء الحيوية Biochemistry
- الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
- علم عقاقير Pharmacognosy
- الطب البديل Alternative Medicine
- علم الأعشاب الصيدلانية Pharmaceutical Herbs
- التكنولوجيا الصيدلية Pharmatical technology
- الصيدلانيات Pharmaceutics
- الصيدلة الحيوية والحرائك الدوائية Biopharmaceutics & Pharmacokinetics
- الصناعة الدوائية Drug Industry
- علم السموم Toxicology
- الوصفات الطبية Prescriptions
- صيدلية المجتمع و أدوية OTC Medicines OTC
- الكيمياء الصيدلية Pharmaceutical chemistry
- الصيدلة سريرية و صيدلية المشافي Clinical & Hospital Pharmacy
- دمويات و مناعيات hematology & immunology
- مراقبة جودة الأدوية Drug Quality Control
- البيولوجيا الجزيئية Molecular Biology
- الصحة العامة و تلوث البيئة General Health
- المنتدى الصيدلاني العام
- الجودة الغذائية Food quality
- قسم الجودة الطبية Department of Medical Quality
- قسم الجودة العام General Quality Department
- قسم السلامة والصحة المهنية Department of Occupational Safety and Health
- قسم جودة وسلامة الأغذية Department of Food Quality and Safety
- المنتدى الطبي العام
- المنتدى الطبي العام
- منتدى العلوم والتكنولوجيا الطبية Medical Technology
- قانون و أخلاقيات المهنة
- تاريخ و آداب الطب
- الدراسات العليا و الدراسة في الخارج
- امتحانات Medical Exams
- تبادل الكتب الطبية و الميديا و البيانات الطبية
- مواضيع طبية غير مصنفة
- قسم الأسرة و المجتمع
- العناية بالمرأة الحامل و المرضع
- تربية الأطفال
- الصحة العامة
- التغذية الصحية و الغذاء الصحي
- أسريات
- 2 استراحة العيادة السورية
- المنتدى العام
- نشاطات و ترفيه
- 1 إسلاميات
- تطوير الذات و البرمجة اللغوية العصبية NLP
- المنتدى التقني
- مكتبة الصور و التصميم
- 1 المنتدى الثقافي و الأدبي
- المنتدى الرياضي
- منتدى اللغات Foriegn Languages
- الساحة العامة
- ساحة الحوار و النقاش
- ترحيب و تعارف
- قسم الاستشارات الطبية
- البحوث والندوات العلمية
- الاقتراحات و التطويرات
- الأقــســـام الــعـــامــة
- منتدى الحوار العام
- المواضيع العامة القديمة المستردة
- المواضيع الحاوية على مرفقات
الرئيسية › علم الصيدلة Pharma › علم الكيمياء Chemistry › الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
معايرات الترسيب
تم تعديل 2009/02/17 في الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
التحليل باستخدام تقنية الناقلية الكهربائية:
مقدمة:
عندما يشكل محلول ما جزء من خلية كهركيميائية فإن كمون هذه الخلية والتيار المار خلالها ومقاومته تعتمد على التركيب الكيميائي لهذا المحلول.
أي أنه يمكن الحصول على بعض المعلومات الكمية والكيفية للمحلول عن طريق خاصة كهربائية واحدة أو أكثر تحت ظروف خاصة وتتضمن طريقة التحليل الكهربائي بشكل عام قسمين رئيسيين:
1 - طرق التحليل باستخدام السلسلة العيارية:
تحضر منها السلسلة العيارية من الكهرليت المدروس وتقاس الناقلية لكل محلول من محاليل السلسلة ونحصل على علاقة خطية بين التركيز والناقلية وتعد هذه الطريقة غير انتقائية لأن الإشارة التحليلية ليست شارة انتقائية بسبب التشويش من جميع الشوارد الموجودة في الكهرليت.
2 – طريقة المعايرة:
حيث نتابع تغيرات خاصة كهربائية (الناقلية) لمحلول يراد معايرته بدلالة حجم الكاشف المضاف ثم ترسم التابعية بين الناقلية و حجم الكاشف لتكون عبارة عن مستقيمات تتقاطع في نقطة التكافؤ ومنها يحدد التركيز المجهول. ويتم بهزه الطريقة رفع انتقائية السلسلة العيارية.
الموجز النظري:
تحتل المعايرة بالناقلية مكانة كبرى عند تحليل المحاليل الملونة والعكرة لتعذر تعيين نقطة التكافؤ بواسطة المشعرات أما الشرط اللازم لتطبيق طريقة المعيرة بالناقلية فهو التغير الملحوظ بالناقلية الكهربائية لمحلول عند بلوغ نقطة التكافؤ ويتوقف تغير الناقلية الكهربائية للمحاليل على تغير حركية الأيونات.
كما تستخدم المعايرة بالناقلية عندما يكون ناتج المعايرة غازاً طياراً أو راسباً قليل الانحلال أو كهرليتا ضعيفاً أو عند حدوث تغير واضح في الناقلية بنتيجة المعايرة.
إن المحاليل الكهرليتية تخضع لقانون أوم, ومقاومتها تكون مستقلة عن القوة المحركة الكهربائية وأي فرق بالكمون كاف لمرور التيار الكهربائي.
وأثبتت التجارب أن الكهرليت يتفكك عند انحلاله إلى شوارد قبل تطبيق الحقل الكهربائي, يتمركز دور هذا الأخير حول تنظيم حركة الشوارد بحث لا تكون عشوائية بل موجهة, فقد تتجه الشوارد الموجبة نحو القطب السالب وتتجه الشوارد السالبة نحو القطب الموجب, أي أن التيار الكهربائي ينقل بواسطة الشوارد.
يجمع قانون أوم:
· شدة التيار I (Coulon/Sec)
· المقاومة R(Ω)
· القوة المحركة الكهربائية E(Volt)
ويعبر عنه بالعلاقة التالية:
وبالتالي مقاومة ناقل معدني تتبع سطح مقطع وطوله:
ῥ: المقاومة النوعية لناقل وهي بالتعريف مقاومة سلك طوله 1cm ومقطعه 1cm2 وبالتالي واحدته (ohm.cm).
وتعرف الناقلية النوعية بأنها مقلوب المقاومة النوعية وواحدتها (ohm.cm-1) وعرف الناقلية بالنسبة للمحاليل الكهرليتية بأنها الناقلية الكهربائية لطبقة من محلول مكعبة الشكل, طول حرفها 1cm محصورة بين مستويين معدنيين متقابلين (مسريين).
تتعلق ناقلية المحلول بالعوامل التالية:
· تركيز الأيونات المشكلة للمحلول: حيث بزيادة التركيز تزداد الناقلية خطياً ضمن مجال معين يختلف باختلاف الأيونات المكونة للمحلول.
· شحنة الأيون: حيث الأيون ذو الشحنة الأكبر يعمل على منح أو كسب الكترونات أكثر من الأيون ذو وبالتالي يساهم في نقل كمية أكبر.
· حركية الأيونات ضمن المحلول: التي تعتمد على عوامل عدة أهمها:
1. نوع المذيب من حيث لزوجته ودرجة حرارته, فبزيادة اللزوجة تنخفض الحركية وبالتالي تقل الناقلية الكهربائية وبرفع درجة الحرارة تزداد حركية الأيون وبالتالي تزداد الناقلية الكهربائية.
2. الجهد المطبق (الكمون) بين المصعد والمهبط في خلية مقياس الناقلية فبزيادة الكمون المطبق تزداد حركية الأيونات لزيادة عدد الالكترونات في المحلول.
3. حجم الأيون فكلما كبر حجمه قلت حركيته وبالتالي ناقليته.
في تجربتنا المذيب هو الماء المقطر والكمون ثابت وبالتالي العوامل المؤثرة على ناقلية المحلول هي بشكل أساسي شحنة الأيون وحجمه وتركيزه ضمن المحلول.
القسم العملي :
التجربة (1) :
- نأخذ (10 ml) من كبريتات الصوديوم و نضعها في دورق حجمي سعة (100 ml) ثم نتمم الحجم بالماء المقطر حتى العلام ثم نجانس المحلول
و نضعه في بيشر , نضع مسرى الناقلة في اليبشر ومن ثم نعاير المحلول بـ كلوريد الباريوم ( 0.1M) نأخذ قيمة الناقلية عند الإضافات :
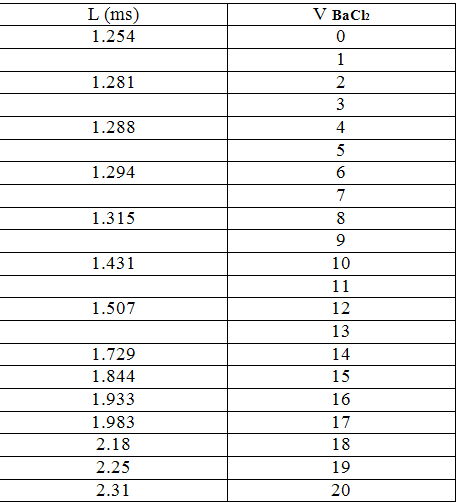
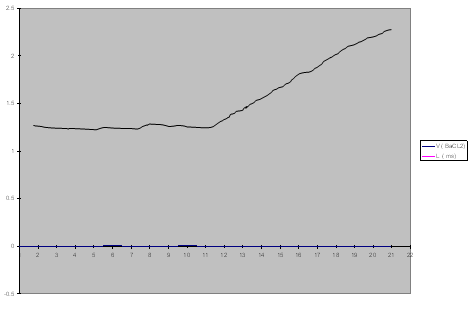
- نلاحظ أن V (eq) = 11
N(SO4-2) =0.022*10 = 0.22
ثانياً:
5ml من كبريتات الصوديوم ← تمديد بالماء المقطر حتى 100ml ثم إضافة BaCl2(0.1N)
بشكل متزايد ثم قياس الناقلية في كل مرة فكانت النتائج على الشكل التالي:
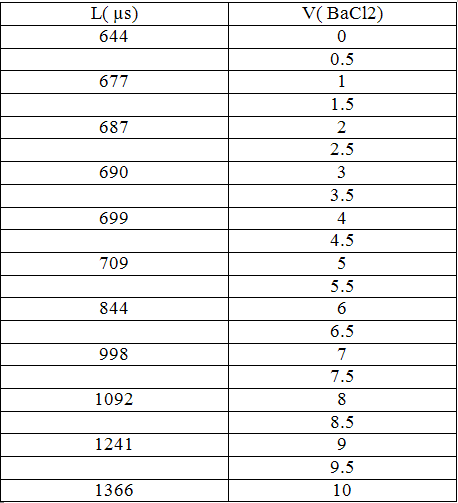
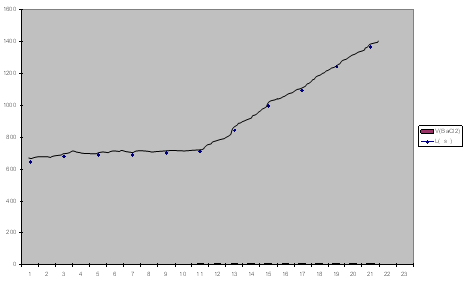
- نلاحظ أن V (eq) = 7.5ml
N( SO4-2) = 0.015 X 20 = 0. 3
ثالثاً: حساب النسبة المئوية لكبريتات الصوديوم في عينة:
نأخذ عينة(1) بوزن تقريبي 0.22gr ونحلها في دورق 100ml ماء مقطر ونتمم حتى العلام ونجانس المحلول وننقله إلى بيشر ونعاير بكلوريد الباريوم 0.1N بشكل متزايد 2ml كل مرة ونقيس الناقلية بعد كل إضافة فكانت النتائج على الشكل الآتي:

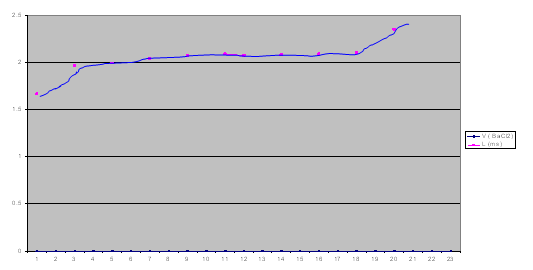
- نلاحظ أن V (eq) = 12 ml
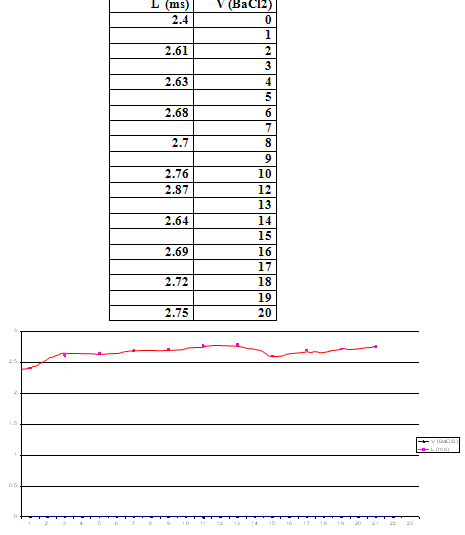
- نلاحظ أن V(eq) = 14ml
مقدمة:
عندما يشكل محلول ما جزء من خلية كهركيميائية فإن كمون هذه الخلية والتيار المار خلالها ومقاومته تعتمد على التركيب الكيميائي لهذا المحلول.
أي أنه يمكن الحصول على بعض المعلومات الكمية والكيفية للمحلول عن طريق خاصة كهربائية واحدة أو أكثر تحت ظروف خاصة وتتضمن طريقة التحليل الكهربائي بشكل عام قسمين رئيسيين:
1 - طرق التحليل باستخدام السلسلة العيارية:
تحضر منها السلسلة العيارية من الكهرليت المدروس وتقاس الناقلية لكل محلول من محاليل السلسلة ونحصل على علاقة خطية بين التركيز والناقلية وتعد هذه الطريقة غير انتقائية لأن الإشارة التحليلية ليست شارة انتقائية بسبب التشويش من جميع الشوارد الموجودة في الكهرليت.
2 – طريقة المعايرة:
حيث نتابع تغيرات خاصة كهربائية (الناقلية) لمحلول يراد معايرته بدلالة حجم الكاشف المضاف ثم ترسم التابعية بين الناقلية و حجم الكاشف لتكون عبارة عن مستقيمات تتقاطع في نقطة التكافؤ ومنها يحدد التركيز المجهول. ويتم بهزه الطريقة رفع انتقائية السلسلة العيارية.
الموجز النظري:
تحتل المعايرة بالناقلية مكانة كبرى عند تحليل المحاليل الملونة والعكرة لتعذر تعيين نقطة التكافؤ بواسطة المشعرات أما الشرط اللازم لتطبيق طريقة المعيرة بالناقلية فهو التغير الملحوظ بالناقلية الكهربائية لمحلول عند بلوغ نقطة التكافؤ ويتوقف تغير الناقلية الكهربائية للمحاليل على تغير حركية الأيونات.
كما تستخدم المعايرة بالناقلية عندما يكون ناتج المعايرة غازاً طياراً أو راسباً قليل الانحلال أو كهرليتا ضعيفاً أو عند حدوث تغير واضح في الناقلية بنتيجة المعايرة.
إن المحاليل الكهرليتية تخضع لقانون أوم, ومقاومتها تكون مستقلة عن القوة المحركة الكهربائية وأي فرق بالكمون كاف لمرور التيار الكهربائي.
وأثبتت التجارب أن الكهرليت يتفكك عند انحلاله إلى شوارد قبل تطبيق الحقل الكهربائي, يتمركز دور هذا الأخير حول تنظيم حركة الشوارد بحث لا تكون عشوائية بل موجهة, فقد تتجه الشوارد الموجبة نحو القطب السالب وتتجه الشوارد السالبة نحو القطب الموجب, أي أن التيار الكهربائي ينقل بواسطة الشوارد.
يجمع قانون أوم:
· شدة التيار I (Coulon/Sec)
· المقاومة R(Ω)
· القوة المحركة الكهربائية E(Volt)
ويعبر عنه بالعلاقة التالية:
I = E/R
وبالتالي مقاومة ناقل معدني تتبع سطح مقطع وطوله:
R = ῥ.L/S
ῥ: المقاومة النوعية لناقل وهي بالتعريف مقاومة سلك طوله 1cm ومقطعه 1cm2 وبالتالي واحدته (ohm.cm).
وتعرف الناقلية النوعية بأنها مقلوب المقاومة النوعية وواحدتها (ohm.cm-1) وعرف الناقلية بالنسبة للمحاليل الكهرليتية بأنها الناقلية الكهربائية لطبقة من محلول مكعبة الشكل, طول حرفها 1cm محصورة بين مستويين معدنيين متقابلين (مسريين).
تتعلق ناقلية المحلول بالعوامل التالية:
· تركيز الأيونات المشكلة للمحلول: حيث بزيادة التركيز تزداد الناقلية خطياً ضمن مجال معين يختلف باختلاف الأيونات المكونة للمحلول.
· شحنة الأيون: حيث الأيون ذو الشحنة الأكبر يعمل على منح أو كسب الكترونات أكثر من الأيون ذو وبالتالي يساهم في نقل كمية أكبر.
· حركية الأيونات ضمن المحلول: التي تعتمد على عوامل عدة أهمها:
1. نوع المذيب من حيث لزوجته ودرجة حرارته, فبزيادة اللزوجة تنخفض الحركية وبالتالي تقل الناقلية الكهربائية وبرفع درجة الحرارة تزداد حركية الأيون وبالتالي تزداد الناقلية الكهربائية.
2. الجهد المطبق (الكمون) بين المصعد والمهبط في خلية مقياس الناقلية فبزيادة الكمون المطبق تزداد حركية الأيونات لزيادة عدد الالكترونات في المحلول.
3. حجم الأيون فكلما كبر حجمه قلت حركيته وبالتالي ناقليته.
في تجربتنا المذيب هو الماء المقطر والكمون ثابت وبالتالي العوامل المؤثرة على ناقلية المحلول هي بشكل أساسي شحنة الأيون وحجمه وتركيزه ضمن المحلول.
معايرات الترسيب ( الناقلية 2)
القسم العملي :
التجربة (1) :
- نأخذ (10 ml) من كبريتات الصوديوم و نضعها في دورق حجمي سعة (100 ml) ثم نتمم الحجم بالماء المقطر حتى العلام ثم نجانس المحلول
و نضعه في بيشر , نضع مسرى الناقلة في اليبشر ومن ثم نعاير المحلول بـ كلوريد الباريوم ( 0.1M) نأخذ قيمة الناقلية عند الإضافات :


علاقة ناقلية المحلول بحجم BaCl2 المضاف
- نلاحظ أن V (eq) = 11
M X V (SO42-) = M X V (Ba+2)
M X 100 = 0.1 X V(eq)
M X 100 = 0.1 X V(eq)
M = V(eq) X 0.1/100 = 11 X 0.1/100 = 0.011
N X E = M X MS
N X 71 = 0.011 X 142
N = 0.022
N X E = M X MS
N X 71 = 0.011 X 142
N = 0.022
N(SO4-2) = N * 10 (عدد مرات التمديد)
N(SO4-2) =0.022*10 = 0.22
ثانياً:
5ml من كبريتات الصوديوم ← تمديد بالماء المقطر حتى 100ml ثم إضافة BaCl2(0.1N)
بشكل متزايد ثم قياس الناقلية في كل مرة فكانت النتائج على الشكل التالي:


علاقة ناقلية المحلول بحجم BaCl2 المضاف
- نلاحظ أن V (eq) = 7.5ml
M X V(SO4-2) = M X V (Ba+2)
M X 100 = 0.1 X 7.5
M X 100 = 0.1 X 7.5
M = 7.5 X 0.1/100 = 0.0075
N X E = M X MS
N X 71 = 0.0075 X 142
N = 0.015
N X E = M X MS
N X 71 = 0.0075 X 142
N = 0.015
N(SO4-2 ) = N X 20 (عدد مرات التمديد)
N( SO4-2) = 0.015 X 20 = 0. 3
ثالثاً: حساب النسبة المئوية لكبريتات الصوديوم في عينة:
نأخذ عينة(1) بوزن تقريبي 0.22gr ونحلها في دورق 100ml ماء مقطر ونتمم حتى العلام ونجانس المحلول وننقله إلى بيشر ونعاير بكلوريد الباريوم 0.1N بشكل متزايد 2ml كل مرة ونقيس الناقلية بعد كل إضافة فكانت النتائج على الشكل الآتي:


- نلاحظ أن V (eq) = 12 ml
M X V(SO4-2) =M X V(Ba+2 )
M X 100 = 0.1 X 12
M= 0.012
N X E = M X MS
N X 71 = 0.012 X 142
N = 0.024
X % = N X E X V K / 1000 X 100/a
X% = 0.024 X 71 X 100/1000 X100 / 0.22
X % = 77.45 %
M X 100 = 0.1 X 12
M= 0.012
N X E = M X MS
N X 71 = 0.012 X 142
N = 0.024
X % = N X E X V K / 1000 X 100/a
X% = 0.024 X 71 X 100/1000 X100 / 0.22
X % = 77.45 %
العينة (2) من كبريتات الصوديوم (وزن العينة = 0.25

- نلاحظ أن V(eq) = 14ml
M X V(SO4-2) = M X V(Ba+2 )
M X 100 = 0.1 X 14
M = 0.014
N X E = M X MS
N X 71 = 0.014 X 142
N =0.028
M X 100 = 0.1 X 14
M = 0.014
N X E = M X MS
N X 71 = 0.014 X 142
N =0.028
X % = N X E X V K / 1000 X 100/a
X% = 0.028 X 71 X 100/1000 X100 / 0.25
X % = 79.52 %
X% = 0.028 X 71 X 100/1000 X100 / 0.25
X % = 79.52 %