|
سرطانة المريء CARCINOMA OF THE OESOPHAGUS
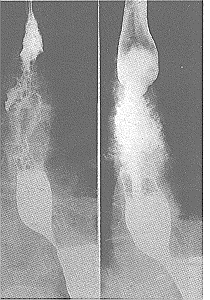
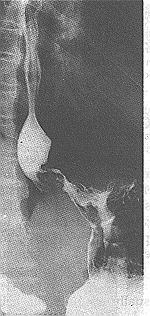
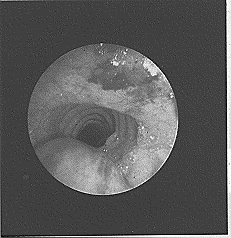
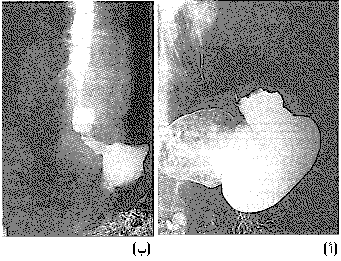
تصيب سرطانة المريء بشكل رئيسي أشخاصـًا فوق الستين من العمر، وهي أكثر شيوعـًا في الرجال منها عند النساء، وتشكل حوالي 5 بالمائة من جميع السرطانات، وتسبب حوالي 4000 وفاة كل سنة في المملكة المتحدة. وربما لا تسبب سرطانة أخرى بؤسـًا أكثر منها، وذلك لأنها تسبب تضيقـًا في المريء، لا يتمكن المريض معه من بلع أي طعام حتى السوائل، وتظهر عليه في مرحلة متقدمة أعراض الاستنشاق الرئوي الانسكابي overspill aspiration pneumonia. المرضيات Pathology. وهذه الآفة من سرطانات الخلية الحرشفية squamous cell (الشكل 63-66). أما السرطانات الغدية adenocarcinoma الحقيقية، فتكوِّن ما بين 3 - 5 بالمائة، وتنشأ في أسفل المريء المُبَطـَّـن بخلايا عمودية. وأما السرطانات الغدية الأخرى فهي عادة من منشأ معدي وتنتشر إلى أعلى لتصيب المريء (الشكل 43-67)، ويتكون بعض منها فعليـًا في فتق فرجوي. ونسب توزيع السرطانة الحرشفية في أجزاء المريء تظهر في الشكل 43-68. وعيانيـًا Macroscopically يمكن تمييز ثلاثة أنواع من السرطانات الحرشفية في المريء وهي: 1. آفات حَلَقِيّة annular تضيُّـقية، وغالبًا ما تصيب فؤاد المعدة. 2. قرحة ظهارومية epitheliomatous ulcer لها حواف مشنوفة everted (الشكل 43-69). 3. كتلة هشة كَمْـئـِـيـَّة fungating تشبه القرنبيط.
الانتشار
Spread.
مباشر
Direct.
وهذه هي الطريقة الرئيسية للانتشار، وأكثرها أهمية بالنسبة
للجراح.
وينتشر المرض بشكل مستعرض وطولاني، وينخر الجدار العضلي،
ليهاجم الأجزاء
باللمفيات Lymphatic. وقد يؤدي نفاذ السرطان للأوعية اللمفية تحت المخاطية إلى تكون عقيدات سواتل satellite nodules بعيدًا عن الورم الرئيسي. وبالمقابل، يحدث الانتشار بطريقة الصِمَّات emboli إلى العقد اللمفية. وينتشر الورم من المريء العنقي إلى العقد اللمفية الواقعة في المثلث فوق الترقوي. وينتشر من المريء الصدري إلى العقد اللمفية جنيب المريء والرغامية القصبية، وللأسفل إلى العقد الواقعة تحت الحجاب. أما في حالة المريء البطني، فينتشر الورم إلى العقد اللمفية في جانب الحنية المعدية الصغرى lesser curvature، وإلى العقد الواقعة حول شريان المحور البطني celiac axis. بتيار الدم Bloodstream. الانتشار إلى الكبد شائع نسبيـًا، وقد تحدث ترسبات عظمية ثانوية أيضًا.
الظواهر السريرية
Clinical features.
يتقدم أعراضَ هذا المرض ظهورُ عسر البلع، وفي كثير من الأحيان
يكون ذلك العرض الوحيد. وبالرغم من أن عسر البلع يزداد سوءاً
بمرور الوقت في أغلب الأحيان، إلا أن تخشر
sloughing
جزء من الورم،
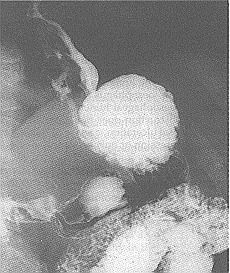
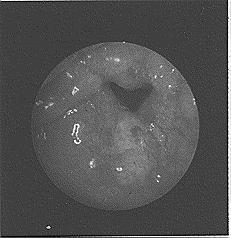
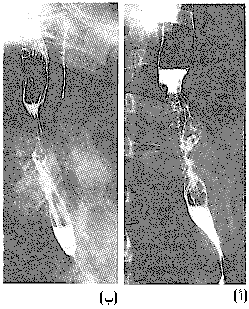
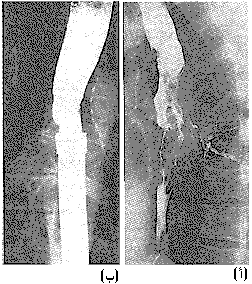
التصوير الشعاعي Radiography عن طريق شرب محلول الباريوم، يجب إجراؤه لكل مريض يشكو من عسر البلع، وعادة يكون تشخيصيًا. تنظير المريء والخزعة Oesophagoscopy and biopsy. يجب إجراؤهما دائمًا، ولكن لا يمكن الحصول على خزعة إيجابية في كل مرة (الشكل 43-70، 43-72)، ويجب أن يأخذ الجراح الحذر في حال حصوله على خزعة سالبة إذا وقع الورم قرب الموصل المعدي المريئي. وإذا لزم الأمر إجراء توسيع للمرىء بسبب عسر بلع خلال شهر واحد، فإن التشخيص غالبا ما يكون سرطانة المريء.
تنظير القصبات Bronchoscopy يجب إجراؤه دائمًا في سرطانة الثلث الأوسط من المريء، فقد يكون الرغامي أو القصبة الرئيسية اليسرى مصابـًا بالورم (الشكل 43-73) مما يسبب السعال والقشع المخطط بالدم. وقد يظهر ناسور قصبي مريئي broncho-oesophageal fistula، ويكون هذا مصحوبًا بازدياد شديد في السعال.
الفحص الخلوي التقشيري Exfoliative cytology. يجرى في الصين غسيل المريء، ومن ثم يتم فحص السائل للبحث عن الخلايا السرطانية، وبهذه الطريقة اكتشفت سرطانات المريء المبكرة في مرحلة كانت فيها الاستقصاءات الشعاعية والتنظيرية سالبة. تخطيط الصدى Ultrasonography. يجب التأكد من عدم وجود رواسب deposits في الكبد في جميع الحالات. وهناك اقتراح الآن بأن تحدد المرحلة في كل مريض باستعمال تفرس التصوير المقطعي المحوسب، مما يغني عن ضرورة تخطيط الصدى. التصوير المقطعي المحوسب Computed tomography. في الحالات المثلى، يجب أن يجرى هذا الاستقصاء ليشمل المسافة بين ثلمة القص sternal notch والســرة، وذلك لتقييم طــول الـــورم وعـرضه، وتصوير العقد اللمفية في المنصف، ومجال الرئتين، والكبد والعقد اللمفية حول شريان المحور البطني celiac axis. وبهذا التصوير يمكن التحقق من أن الآفة غير قابلة للشفاء، ولكن لا يمكن بطريقة موثوقة التأكد من أن الآفة لا تستأصل. وكذلك يمكن لهذا التصوير أن يبين تضخم العقد اللمفية، ولكنه لا يبين إن كانت العقد مرتشحة infiltrated بالسرطانة أم لا. ومع تقنيات التصوير الحديثة، يمكن المساعدة في اتخاذ القرار بإجراء عملية جراحية أو عـــــدم
إجرائها، ولكن لا يمكن دائمًا المساعدة في اتخاذ القرار داخل العمليات حول امكانية الاستئصال الموضعي باستعمال التصوير المقطعي المحوسب أو باستعمال تخطيط الصدى الداخلي من داخل اللـُمْعَة intraluminal ednosonography. تخطيط الصدى من داخل اللـُمْعَة Endoluminal ultrasonography. أدخلت هذه التقنية حديثًا. ويُدْخَلُ مسبار تخطيط الصدى الدقيق عبر المنظار اللين. فإذا كان من الممكن منابلة المسبار إلى داخل لـُمْعَة الورم، فيمكن تصوير درجة انتشار الورم عبر المنصف (وضخامة العقد اللمفية الموضعية). ويعاني كثير من هؤلاء المرضى من نقص التغذية، وكذلك يجب قياس الهيموجلوبين وبروتينات البلازما وكيمياء الدم الحيوية. وإذا لزم الأمر، يجب تصويبها خاصة قبل إجراء العمليات الجراحية.
المعالجة TREATMENT
المبادىء الأساسية Principles يجب عدم إجراء فغر المعدة gastrostomy لعلاج سرطان المريء. إذ لم يعد لها حاجة كتدبير لتحسين تغذية المريض قبل إجراء العملية الجراحية. فبالإمكان الآن تدبر أمر التغذية عن طريق أنبوب رفيع 2-3 مم مقيم يُدْخَلُ للمعدة عن طريق الأنف، أو باستعمال التغذية الوريدية الأكثر حداثة. ويجب عدم إجراء فغر المعدة فقط لإطالة بقاء مريض يجد صعوبة في البلع، إذ عندما يتقدم به المرض، يصبح غير قادر على بلع لعابه وهذا يؤدي إلى مضاعفات بالرئة نتيجة استنشاق اللعاب، وعندها يصبح مصابه أعظم جللاً.
ويتم العلاج لأجل الشفاء إما عن طريق قطع resection (استئصال) الورم، أو بمساق من المداواة الجذرية بالأشعة radical radiotherapy. ولا يناسب هذا النوع من العلاج الشافي إلا حوالي 25 بالمائة من المرضى. وأما بقية المرضى فيحتاجون لعلاج ملطـِّف palliative، إما بمجازة ملطـِّفة palliative bypass أو بالمداواة بالأشعة الملطـِّفة palliative radiotherapy. ويجب أخذ الحذر عند استعمال هذه المصطلحات. إذ يعني القطع الشافي curative resection أنه لم يترك في المكان أي ورم عياني. والقطع الملطـِّف يعني أن ورمًا عيانيـًا قد ترك فعلاً في موضعه. ويجب دائمًا إجراء تأكيد نسيجي للقطع الشافي بفحص انتشار الحواف الجانبية والامتداد الطولي للورم. والقابلية للعميلة operability اصطلاح يطلق على قرار إجراء العملية بدلاً من القدرة الفنية على إجراء القطع، سواء كان ذلك من أجل الشفاء أو من أجل التلطيف. وتحمل أي عملية خطر الوفاة mortality risk، وبهذا يجب أن يكون معدل القابلية للعملية مساويًا لمعدل القطع كلما أمكن. ويمكن علاج عسر البلع بالتنبيب intubation أو اجتثاث الورم داخل اللـُمْعَة باستعمال الليزر، ولكن من الواضح أن هذه الإجراءات لا تؤثر على إنذار prognosis الورم نفسه. ومن المؤسف أنه في حوالي 25 بالمائة من المرضى الذين يجيئون في مرحلة متقدمة من مرضهم، هم عليلون لدرجة أنه لا يمكن أن يقدم لهم علاج غير إجراءات قصيرة الأجل، بهدف تخفيف معاناتهم.
المعالجة الشافية بالجراحة Curative treatment by surgery وتهدف الجراحة إلى إزالة الورم مع استعادة الاستمرارية بإقحام المعدة أو الصائم أو القولون. ويجب محاولة استعمال المعالجة الشافية إذا تحققت الأمور التالية: (أ) أن يوحي المظهر العام بأن المريض قادر على تحمل عملية جراحية كبيرة جدًا؛ (ب) عدم وجود دليل على انتشار الورم للعقد فوق الترقوة، أو الشجرة الرغامية القصبية أو الكبد.
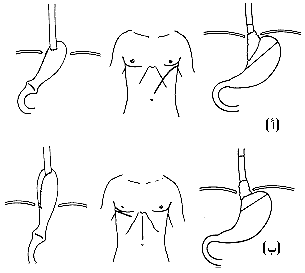
السرطانة خلف الحلق Postcricoid carcinoma. وللحصول على فرصة جيدة للشفاء، يجب ألا يكون الورم منتشرًا كثيرًا إلى الجوانب (وحشيًا)، وعلى الجراح أيضًا أن يستأصل هامشـًا طوله عشرة سنتيمترات على الأقل لتقليل خطر الرجعة في موقع المفاغرة. وهذا يعني أنه يصعب الحصول على هامش كاف في أورام خلف الحلق وثلث المريء العلوي: لهذا يجب علاج سرطانة خلف الحلق بالمداواة بالأشعة radiotherapy. والمعالجة الجراحية البديلة باستئصال البلعوم والحنجرة pharyngolaryngectomy مع تغيير وضع transpostion المعدة أوالقولون وفغر الرغامى، وهذا إجراء كبير تصحبه نسبة عالية من المضاعفات. سرطانة ثلث المريء العلوي Carcinoma of the upper third of the oesophagus. يندر تشخيص سرطانات هذا الجزء من المريء في مرحلة مبكرة، إذ غالبًا ما يكون السرطان منتشرًا للعقد اللمفية العنقية عند ظهور عسر البلع، أو يكون العصب المبهم الراجع مشلولاً، مما يشكل دليلاً على أن المرض لا يعالج جراحيـًا. وفي هذه الحالة، تكون المعالجة الوحيدة التي يمكن تقديمها للمريض هي المداواة بالأشعة. أما في الحالات النادرة، فيمكن علاج هذه الآفة جراحيـًا باستعمال طريقة ماكـِّيوين في استئصال المريء على ثلاثة مراحل McKeown three-stage oesophagectomy (لمزيد من التفاصيل، انظر لاحقـًا)، أو استعمال استئصال الورم، وإعادة الاستمرارية تغيير وضع (إقحام) الصائم أو القولون jejunal or colonic transpostion. سرطانة ثلث المريء الأوسط Carcinoma of the middle third of oesophagitis. قد يلتصق الورم المتكون في هذا الجزء من المريء بالأبهر أو الوريد الفرد azygus vein أو القصبة الرئيسة اليسرى. وإذا كان الورم يسمح بالجراحة، فيُنَفـَّذ الاستئصال بمفاغرة عالية، ولكن ينصح بعض الناس هذه الأيام بمعالجة هذه الآفات بالمداواة بالأشعة إذا اعتبرت الوفيات والمراضة غير مقبولتين. أما إذا عولجت بالجراحة، فيتم ذلك بالاستئصال المعدي المريئي، ومن ثم تجري المفاغرة في مستوى فوق قوس الأبهر، إما عبر الصدر أو من شقٍّ عنقي منفصل. ويستأصل خُمْسُ المعدة فقط، ويستحسن أن تجري هذه العملية بطريقة آيفور لويس Ivor Lewis operation. ويمكن أن تجري هذه العملية أيضـًا في بعض الحالات بصعوبة أكثر بطريق صدري بطني أيسر. عملية آيفور لويس Ivor Lewis operation، (الشكل 43-75) (وهي مرحلتان - بطنية وبضع صدري أيمن). وتُحَرَّكُ المعدة أولاً من خلال شقٍّ ناصف أو جنيب ناصف، ومن ثم يتم الوصول إلى المريء من الجانب الأيمن. ويفضل هذا الطريق لأن المدخل إلى المفاغرة، وهو أمر حيوي في العملية الجراحية، لا يعيقه قوس الأبهر كما هو الحال عند الاقتراب من خلال بضع صدر أيسر.
الطريق الصدري-البطني الأيسر
Left
thoraco-abdominal approach
(الشكل 43-75). يُجْرَى شقٌّ طويل في الجلد والعضلات، ومن ثم
يُبْضَعُ الصدر من فراش الضلع
الثامن (ويمد الشقُّ إلى البطن إن لزم الأمر). ويجرى شق شُعِّي
في
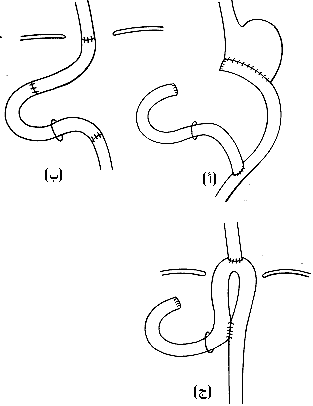
سرطانة الثلث الأسفل من المريء والفؤاد Carcinoma of the power third of the oesophagus. ويمكن استئصالها استئصالاً معديـًا مريئيـًا جزئيـًا من خلال شقٍّ صدري بطني من فراش الضلع الثامن - مع مدِّ الشقِّ إلى البطن. ومقارنةً بسرطانة ثلث المريء الأوسط، يزال جزء أكبر من المعدة في حالات سرطان الجزء الأسفل (ثلثا المعدة)، وغالبًا ما يستأصل الطحال معها. وإذا أجريت للمريض عملية استئصال معدة جزئي سابقـًا، أو إذا كان مصابـًا بقرحة اثناعشرية مع وجود تليف وتقلص، فإن من الصعب إجراء مفاغرة مريئية معدية من دون توتير خط خياطة المفاغرة، وعندئذ يمكن إجراء إحدى العمليات التالية: روو-في -Y (Roux-En- Y) مع استئصال المعدة الكلي وإجراء مفاغرة صائمية صائمية (الشكل 43-76 أ). وتستعمل هذه التقنية التي تتضمن مفاغرتين لمنع جزر reflux الصفراء وعصارة البنكرياس ودخولهما المريء إذ يؤدي ذلك إلى حدوث التهاب المريء، ومن ثم تضيقه. عروة روو Roux Loop، وتشمل استئصال المعدة الكلي وإقحام قطعة من الأمعاء (الشكل 43-76 ب). مفاغرة براون* Braun anastomosis، لمنع جزر الصفراء (الشكل 43-76 ج). إقحام القولون Colon interpostion.
الاستئصال المريئي المعدي Oesophagogastrectomy بواسطة بضع الصدر الأيمن Through right thoracotomy، مسبوقـًا بشقِّ البطن لتحريك المعدة (عملية آيفور لويس Ivor Lewis operation).
الشق جنيب الناصف أو في خط الوسط
Paramedian or
midline incision.
تُنَفـَّذ فتحة في الثرب
omentum
المعدي القولوني بمحاذاة المنحنى المعدي الأكبر
greater curvature،
مع
المحافظة على
القوس المعدي الثربي الأيمن
right gastro
epiploic arch.
ومن ثم يُفْصَلُ الشريان
المعدي القصير والشريان المعدي الثربي الأيسر. بضع الصدر الأيمن Right thoracotomy من فراش الضلع الخامس. ويُفْصَلُ الوريد الفرد azygos، وتُسْحَبُ المعدة والمرىء إلى الصدر، وتفصل المعدة بشكل مائل، وتُقْفَلُ بطبقتين من الغرز. وكبديل، يمكن إقفال المعدة بآلة الرز stapler، مع إحكام ذلك باستعمال خيط يقلب للداخل inverting. ويُفْصَلُ المريء على بعد 10 سم من الورم. وهذه المسافة ضرورية، لأن انتشار السرطانة تحت مخاطية المرىء يكون دائمًا أكثر مما هو متوقع، ومن ثم تُجْرَى مفاغرة بين المريء وفتحة جديدة في قاع fundus المعدة. ويجب إدخال أنبوب عبر الأنف إلى ما يتبقى من المعدة بغرض المص بعد العملية. ويُنزح الصدر عن طريق أنبوب قِمّيّ apical، وأنبوب قاعدي basal، وتوضع نهايتاهما بالقرب من المفاغرة، وأخيرا يُقْفَلُ الصدر طبقة طبقة.
باستخدام بضع الصدر الأيسر Through left thoracotomy (باستعمال طريق من فراش ضلعين لعلاج أورام ثلث المريء الأوسط، وذلك عندما تكون مفاغرة المريء والمعدة عالية في الصدر). ويُجْرَى شقٌّ طويل خلفي جانبي بمحاذاة الضلع الثامن، ويُمَدُّ إلى البطن باتجاه السرة. ويُفْتَحُ فراش الضلع الثامن، ومن ثم يُجْرَى شقٌّ شُعِّي في الحجاب، يبدأ من الفتحة الفرجوية المريئية، ويتجه وحشيـًا. وهذا يمكـِّن تحريك المعدة، بالطريقة التي وصفت أعلاه كما هو الحال في عملية آيفور لويس. وتُفْصَلُ المعدة بشكلٍ مائل، ومن ثم تُقْلَبُ للأعلى، وتُحَرَّكُ سرطانة المريء. ويُفْصَلُ المريء على بعد 10 سم من حافة الورم، وذلك لأن انتشار السرطانة تحت مخاطية المرىء أكثر مما هو متوقع دائمـًا. وبعد ذلك، تُجْرَى مفاغرة المعدة بالمريء كما وُصِفَ سابقًا. وفي حالات سرطانة ثلث المريء الأوسط، يجب إجراء المفاغرة إلى الجانب الإنسي أو الوحشي من قوس الأبهر، وتيسيرًا للأمر، يُبْضَعُ الصدر ثانية، (من خلال الشق الجلدي والعضلي نفسه)، ولكن في مستوى فراش الضلع الخامس. ويتم إدخال أنبوب أنفي معدي إلى الجزء المتبقي من المعدة، حتى يُسْتَعمَلَ للمص بعد العملية. ويُنزح الصدر بأنبوب قِمِّيٍّ apical وآخر قاعدي basal، وتوضع نهايتاهما قرب المفاغرة. وأخيرًا يقفل الصدر طبقة طبقة.
استئصال المريء التام Total oesophagectomy ويُنْصَحُ في حالات أورام النصف العلوي من المريء، بإجراء استئصال تام للمريء مع إجراء مفاغرة بين قاع fundus المعدة والمريء في العنق (عملية ماكـِّيوين McKeown ذات ثلاث المراحل). وإذا حصل تسرب تفاغري بعد العملية، فلا يكون له عواقب وخيمة، لعدم حدوث تلوث الجَنَبة pleura. ويكون التسرب المشار إليه في العنق، وهذا سريع الشفاء، ويمكن بذلك تجنب تبعات هذه المضاعفة المميتة. إن الخطوتين الأوليين لهذه العملية، هما نفس الخطوتين الأوليين في عملية آيفور لويس Ivor Lewis، وتتضمنان تحريك المعدة تحريكًا تامـًا، وكذلك تحريك المريء الصدري. وبعد ذلك، يتم كشف المريء العنقي من شقٍّ بمحاذاة الحد الأمامي للعضلة القصية الخشائية sternomastoid اليمنى. وتُقطع العضلة اللامية الكتفية omohyoid وتُفصل، ويُقطع الوريد الدرقي الأوسط والشريان الدرقي الأسفل. وبعد ذلك، تُجَرُّ المعدة والمريء من خلال الجرح في العنق. ويجب عدم إجراء هذا الكشف (الجزء من العملية) من جهة الرقبة اليسرى، وذلك لتجنب إصابة قناة الكيلوس chyle duct. وتُقطَع المعدة والمريء كما وصف سابقـًا، وتُجْرَى المفاغرة.
طريق التنظير الصدري Thoracoscopic approach تم حديثــًا استعمال منظار البطن كأداة صدرية من أجل تحريك المريء كجزء من استئصال المريء التام لمعالجة السرطانة. وإذا كان الورم يتحرك، فإن هذا الطريق يشكل بديلاً ممكنـًا (ومقبولاً) لبَضْع الصدر. ولكن يجب الانتظار لرؤية ما إذا كانت إزالة الورم بهذا الإجراء قليل الغزو minimally invasive procedure فعالة كما هو الحال في الطريق المفتوح. ولكل إجراء مضاعفاته، ورجعة الورم في ثقوب المداخل مضاعفة نادرة لهذا الطريق.
المعالجة الشافية بالمداواة بالأشعة Curative treatment by radiotherapy
والمداواة بالأشعة خيار مقبول في معالجة سرطان المريء، لأن
الغالبية العظمى من
هذه السرطانات هي من نوع الخلية الحرشفية
squamous cell
carcinoma
(الشكل 43-77). ويجب أن تشمل المعالجة بالأشعة مناطق المريء
الواقعة تحت الورم وفوقه، وكذلك الأنسجة المجاورة للورم
الواقعة في المنصف الخلفي
posterior
mediastinum،
لذا فإن المجال الشعاعي الأسطواني غالبًا ما يشمل جميع المريء
بطول 25 سم.
والمجال الشعاعي المستعمل هو ثلاثي الأبعاد، ويتطلب الحذر
الخاص لتجنب إصابة النخاع
الشوكي
والرئتين. ويستحسن إعطاء الجرعة الشعاعية ذات المليون فولط megavoltage بمسارع خطي linear accelerator. وتختلف الجرعة بين 5000 cGy، (20 جرعة يومية مكونة من 250 cGy على مدار أربعة أسابيع) وبين 6000 cGy (30 جرعة جزئية مكونة من 200 cGy على مدار ستة أسابيع). وتهدف المداواة بالأشعة إلى تخفيف حجم الورم الواقع داخل اللـُمْعَة intraluminal، ولذا تعتبر المداواة بالأشعة ملاءمة ومؤثرة أكثر في معالجة الأورام ذات الحجم الكبير، وهي أقل كفاءة في معالجة السرطانات المتقرحة التي تصيب فؤاد المعدة. والجراحة أفضل سبل معالجة النوع الأخير من هذه السرطانات. نتائج المعالجة بالجراحة والمداواة بالأشعة Results of surgery and radiotherapy. إن النسبة الإجمالية لوفيات سرطان المريء هي 18 بالمائة في السنة الأولى و6 بالمائة في السنوات الخمس التالية. ويجب أن يؤدي الاستئصال الجراحي إلى بقيا survival لمدة سنة بنسبة 45 بالمائة، وإلى بقيا لمدة خمس سنوات بنسبة 15 بالمائة. ويجب ألا تزيد نسبة الوفيات الناجمة عن الجراحة على 15 بالمائة، على أن تتضمن هذه النسبة ليس فقط حالات الوفاة خلال ثلاثين يومًا، بل جميع الوفيات خلال وجود المريض في المستشفى بعد إجراء العملية الجراحية. (والأورام التي يتم تشخيصها في مرحلة مبكرة، يجب أن تعطي نتائج أفضل، فعلى سبيل المثال، إن نسبة البقيا لخمس سنوات هي 60 بالمائة تقريبـًا للأورام في مرحلة و0 T0، و1 T1 (و من ورم)، أما مرحلة ع0 (ع من عقد) N0، فتعطي نسبة بقيا لسنة مقدارها 70 بالمائة، ونسبة بقيا لخمس سنوات مقدارها 40 بالمائة. ومن بين أربعة آلاف حالة سرطانة المريء، التي تكتشف سنويـًا في المملكة المتحدة، يعالج ألف (25%) فقط بالاستئصال، وذلك لأن كثيرًا منهم يشخصون في مراحل المرض المتقدمة (المرحلة الثالثة والرابعة (75 بالمائة))، وبعض هذه الحالات مرضى تقدمت بهم العمر لدرجة تجعل إجراء جراحة كبرى أمرًا متعذرًا (40 بالمائة منهم فوق سن الخامسة والسبعين). وتشمل نسبة 25 بالمائة التي تعالج بعمليات الاسئتصال 5 بالمائة في المرحلة الأولى و20 بالمائة في المرحلة الثانية. ويجب أن تشمل نتائج معالجة سرطان المريء مرحلة المرض ونسبة الوفيات. وكذلك يجب تصميم المعالجة لتكون شافية curative (أي لا تُبْقَى ورمـًا عيانيـًّا)، أو ملطـِّفة palliative (حيث تُبْقَى ورمـًا عيانيـًّا). وعند استعمال الفحص المجهري في تحديد مرحلة المرض بعد إجراء العملية، يتبين أن الورم يستأصل في خمسين بالمائة من الحالات استئصالاً ناقصـًا، إذ تبقى أجزاء من الورم في المنصف، كما تبقى أجزاء من الورم في نهاية المريء المقطوعة في 25 بالمائة من الحالات. وتجدر الإشارة إلى أنه لا يوجد إثبات على أن التوسع في الاستئصال يؤدي إلى زيادة نسبة استئصال الورم استئصالاً تامـًا، أو يؤدي إلى نسبة بُقْيَا أفضل عند هؤلاء المرضى. أما تقييم نتائج المداواة بالأشعة فهو أمرٌ صعب، لأن أغلب هؤلاء المرضى قد تخلى عنهم الجراحون إلى الأشعة بقصد المعالجة الملطـِّفة. وهناك دلائل على أنه إذا أرسل المرضى المُعَالَجُونَ جراحيـًا بقصد الشفاء للعلاج بالأشعة بقصد الشفاء فيمكن الحصول على نسبة بقاء لسنة مقدارها 45 بالمائة، ونسبة بقاء لخمس سنوات مقدارها 15 بالمائة، مع فائدة إضافية وهي عدم الحاجة لعملية جراحية، وعدم وجود نسبة وفيات جراحية. ومع غياب الدراسات المقارنة، يجب القول الآن إن المعالجة بإحدى هاتين الطريقتين (الجراحة أو المداواة الأشعة) في حقيقة الأمر لا تَفْضُل الطريقة الأخرى. ويقتضي العلاج الأمثل لمثل هذه الحالات، أن تتوافر لدى اختصاصي علاج أمراض المريء فرصة لمعالجة مرضاه بالأشعة بقصد الشفاء، أو بقصد ملطـِّف.
العلاج المساعد Adjuvant therapy لقد استعملت المداواة بالأشعة أو العلاج الكيميائي كمعالجة إضافية للجراحة في مرضى سرطان المريء. ولكن الفوائد لم تظهر بصورة جلية. ومن الواضح نظريًا، أن أفضل سبل العلاج الإضافي هو المداواة بالأشعة بعد إجراء العلاج الجراحي، ولكن لا يُنْصَحُ بهذا عادةً. ومن مساوئ استعمال المداواة بالأشعة قبل المعالجة الجراحية بروزُ مشكلة قصور الالتئام، وتسرب المفاغرة الناجم عنها، ومشكلة تأذي الرئة. العلاج الملطـِّف Palliative treatment يستعمل العلاج الملطـِّف في مداواة المرضى الذين لا تسمح حالتهم العامة بإجراء عملية استئصال بغرض الشفاء، والذين يعانون من ترسبات سرطانية، أو الذين يتبين في أثناء بضع الصدر أو بضع البطن أن ورمهم غير قابل للقطع. ففي مثل هذه الحالات، يجب استعمال علاج ملطـِّف لتسهيل البلع، ويكون ذلك، إما بتحويل مجرى الطعام، أو بالتنبيب. كما يمكن استعمال المداواة بالأشعة (الشكل 43-78)، أو العلاج بالليزر لهذا الغرض. وكثير من الحكمة والدراية ضرورية للتأكد من أن العلاج الملطـِّف لن يؤدي لتعاسات إضافية، مثل التسبب بناسور مريئي رغامي tracheo-oesophageal fistula. وعادة تنقص لـُمْعَة ورم المريء غير المعالج إلى 3 مم أو أقل، بينما القطر الخارجي لأغلب الأنابيب المستعملة في التنبيب هو 15مم، لهذا هناك خطر عظيم من حدوث الانثقاب أثناء التوسيع والتنبيب. وإذا استعمل الليزر أو الإنفاذ الحراري في العلاج مع أو من دون مداواة بالأشعة، فإن حجم اللـُمْعَة سيزداد،
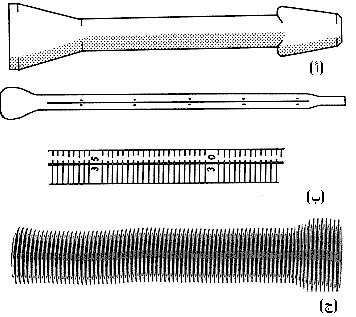
ويصبح التنبيب أقل خطورة، وكثيرًا ما يمكن الاستغناء عنه. والرسالة المهمة هي أنه يجب توافر جميع أنماط المعالجة وأنه يجب استعمال أي منها إما منفردة أو مجتمعة مع أنماط أخرى. وحتى عند وجود ناسور رغامي أو قصبي مريئي، فيمكن للتنبيب أن يساعد المريض (الشكل 43-39). وغالبية التنبيب، باستعمال أي نوع من الأنابيب، يمكن الآن إجراؤه عن طريق التنظير من دون ما حاجة لجراحة مفتوحة. التنبيب عبر الورم Intubation tube through growth. وتتوافر عدة أنواع من هذه الأنابيب. أنبوب نوتنجهام (أتكينسون)* Nottingham (Atkinson) Tube. ونهايته العليا على شكل محقن، وله حافة جانبية سفلى تمنع انزلاقه إلى أعلى، ويمكن إدخاله عبر منظار المريء من دون حاجة لعملية جراحية.
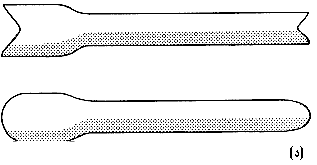
أنبوب سيليستين* Celestin Tube (أنبوب مقوى له ذيل طويل). ونهايته العليا على شكل الخزامى tulip-shaped، وهذا ما يمنعه من السقوط إلى أسفل عبر التضيق. ولـُمْعَته lumen أكبر من لـُمْعَة أنبوب سوتار. ويمكن أن يُدْخَلَ ذيله عبر التضيق إلى المعدة باستعمال منظار المريء، ومن ثم يبضع البطن، وتفتح المعدة، ويُسْحَبُ الذيل، حتى يرقد جزءه العلوي مرتاحًا فوق التضيق. أنبوب سوتار* Souttar tube (سلك فضي ألماني ملفوف).
يتم توسيع التضيق أولاً باستعمال شمعة bougie مطاطية لينة للحجم الذي يسمح بمرور أنبوب سوتار، وبعد ذلك، تُدْخَلُ شمعة أصغر عبر التضيق، ويُدْخَلُ أنبوب سوتار فوق الشمعة الصغيرة، ويُدْفَعُ عبر التضيق. وتقلل هذه التقنية من مخاطر حدوث ثقب المريء، علما بأن الثقب هو أيضًا من مخاطر التوسيع الأولى للمرىء. ولا يناسب أنبوب سوتار ولا غيره من أنواع الأنابيب الأخرى كمعالجة ملطـِّفة لأورام الجزء الأعلى من المريء، لأنها تسبب تهيجًا للحنجرة. ويمكن الآن إدخال أنبوب سلستين باستعمال المنظار كبديل، باستعمال مدخل introducer خاص، عبر الورم من دون حاجة لعملية بضع البطن. أنبوب بروكتور-ليفينجستون Proctor-Livingstone tube ويستعمل بصورة رئيسية في جنوب إفريقيا حيث توجد هناك نسبة مرتفعة من سرطانة المريء، ويجيء المرضى متأخرين. ويمنع الشكل الذي يشبه فم السمكة حدوث الزوايا الحادة عند عَصْر الأنبوبة حتى تصبح منبسطة. عمليات التحويل القصيرة الملطـِّفة Palliative short circuit operations. تُجْرَى هذه العمليات لعلاج ورم لا يستأصل، وتشمل عملية مفاغرة مريئية معدية ملطـِّفة palliative oesophago-gastric operation، أو مفاغرة مريئية صائمية ملطـِّفة مع عروة روو في Y (palliative oesophag-jejunostomy with Roux-en-y loop) (لمنع حدوث جزر reflux معدي). ومن مساوئ هذه العمليات، خطر حدوث تسرب تفاغري anastomotic leak، ولذا يفضل استعمال التنبيب على المفاغرة. التلطيف بالمداواة بالأشعة Palliative radiotherapy. وكثيرًا ما يكون المريض عليلاً لدرجة لا تسمح باستعمال مساق جذري من المداواة بالأشعة لمدة 4-6 أسابيع، وقد يتم تفريج أعراضه باستعمال مساقات أقصر. والمداواة بالأشعة فعالة حتى في سرطانة المريء الغدية، حتى لو كانت ناشئة من المعدة، ويمكن الحصول على تفريج عسر الهضم بإنقاص كتلة (حجم) الورم (الشكل 43-78). العلاج بالليزر Lazer treatment. يستعمل هذا النوع من العلاج، لتحطيم جزء الورم البارز في داخل اللـُمْعَة intraluminal، مما يُمَكـِّنُ المريض من بلع السوائل ويجنبه الاختناق بلعابه. المضاعفات النهائية Terminal complications. في حال عدم استئصال الورم، فإنه يسبب الموت بإحدى الوسائل التالية: 1. الدنف cachexia والتجفاف dehydration المتزايد. 2. ذات الرئة pneumonia الناجم عن ثقب جزء من القصبات. 3. التهاب المنصف mediastinitis الناجم عن ثقب المريء إلى المنصف الخلفي. 4. تآكل الأبهر (نادر الحدوث). * هنريك براون Heinrich Braun، 1862-1934. جراح، ألمانيا. * مايكل أتكينسون Micheal Atkinson، معاصر. جراح، أستاذ الجهاز الهضمي، جامعة نوتنجهام، انجلترا. * لويس روجر سيليستين Louis Roger Celestin، معاصر. جراح، مستشفى فرنشي، بريستول، بريطانيا. * سير هنري سوتار Sir Henry Souttar، 1875-1964. جراح، مستشفى لندن، لندن، انجلترا.
|