مرحبا بك في هذا المنتدى !
يبدو أنك جديد هنا. إذا كنت تريد أن تتورط، انقر فوق أحد هذه الأزرار!
روابط سريعة
الأقسام
- 9.5K جميع الأقسام
- العلوم الطبية الأساسية Basic Medical Sciences
- علم التشريح العام و الجنين Anatomy and Embryology
- علم وظائف الأعضاء (الفيزيولوجيا) Physiology
- علم النسج Histology
- علم النسج العام ( عدا الأسنان ) General Histology
- علم النسج الخاص بالأسنان Oral histology
- علم الخليةو الحياة Biology
- علم التشريح المرضي Pathology
- التشريح المرضي العام ( عدا الأسنان ) Pathology
- التشريح المرضي الخاص بالأسنان Oral Pathology
- علم الأحياء الدقيقة Microbiology
- الجراثيم و الفيروسات Germs and Viruses
- الطفيليات الطبية Parasitology
- الفطور و الحشرات Insects and Fungi
- علم الوراثة الطبية Medical Genetics
- علم المناعة الطبية Medical Immunology
- 4 العلوم الطبية السريرية Clinical Medical Sciences
- الأمراض الداخلية Internal Medicine
- 4 الجراحة Surgery
- التوليد و الأمراض النسائية Gynacology & Obstetrics
- الصحة الجنسية Sexual Health
- طب الأطفال Pediatrics
- الجلدية Dermatology
- العينية Ophthalamology
- انف و أذن و حنجرة Ear, Nose, and Throat
- الطب المخبري labratory Medicine
- علم الأورام Oncology
- الطب الشرعي Forensic Medicine
- الطب النفسي Psychiatric
- التغذية والطب البديل Nourishments and Alternative Medicine
- طب الطوارئ و الإسعافات الأولية Emergency Medicine And Primary aids
- متلازمات طبية Medical Syndromes
- علم الأشعة Radiology
- طب الأسنان Dental Medicine
- التعويضات المتحركة الكاملة و الجزئية Removable Prothodontics
- المداواة الترميمية operative dentistry
- المداواة اللبية Endodontics
- طب أسنان الأطفال Pediatric Dental
- جراحة الوجه والفكينoral surgery
- التعويضات الثابتة Fixed Prothodontics
- المواد السنية dental materials
- النسج حول السنية periodontology
- التقويم Orthodontics
- منتدى فنيي الأسنان dental technicians
- طب الفم العام general oral medicine
- علم الأشعة Radiology
- حالات سريريةClinical Cases
- أخر مستجدات طب الأسنان last news
- المنتدى الطبي السني العامgeneral dentistry
- علم الصيدلة Pharma
- علم الأدوية
- علم الأدوية Pharmacology
- أدوية الطوارئ Emergency drugs
- المضادات الحيوية Antibiotics
- الأدوبة المسببة للتشوهات الجنينية Teratogenic drugs
- أدوية Drugs
- علم الكيمياء Chemistry
- كيمياء حيوية سريرية Clinical Biochemistry
- الكيمياء العامة و العضوية و الفيزيائية General & organic chemistry & physical
- الكيمياء الحيوية Biochemistry
- الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
- علم عقاقير Pharmacognosy
- الطب البديل Alternative Medicine
- علم الأعشاب الصيدلانية Pharmaceutical Herbs
- التكنولوجيا الصيدلية Pharmatical technology
- الصيدلانيات Pharmaceutics
- الصيدلة الحيوية والحرائك الدوائية Biopharmaceutics & Pharmacokinetics
- الصناعة الدوائية Drug Industry
- علم السموم Toxicology
- الوصفات الطبية Prescriptions
- صيدلية المجتمع و أدوية OTC Medicines OTC
- الكيمياء الصيدلية Pharmaceutical chemistry
- الصيدلة سريرية و صيدلية المشافي Clinical & Hospital Pharmacy
- دمويات و مناعيات hematology & immunology
- مراقبة جودة الأدوية Drug Quality Control
- البيولوجيا الجزيئية Molecular Biology
- الصحة العامة و تلوث البيئة General Health
- المنتدى الصيدلاني العام
- الجودة الغذائية Food quality
- قسم الجودة الطبية Department of Medical Quality
- قسم الجودة العام General Quality Department
- قسم السلامة والصحة المهنية Department of Occupational Safety and Health
- قسم جودة وسلامة الأغذية Department of Food Quality and Safety
- المنتدى الطبي العام
- المنتدى الطبي العام
- منتدى العلوم والتكنولوجيا الطبية Medical Technology
- قانون و أخلاقيات المهنة
- تاريخ و آداب الطب
- الدراسات العليا و الدراسة في الخارج
- امتحانات Medical Exams
- تبادل الكتب الطبية و الميديا و البيانات الطبية
- مواضيع طبية غير مصنفة
- قسم الأسرة و المجتمع
- العناية بالمرأة الحامل و المرضع
- تربية الأطفال
- الصحة العامة
- التغذية الصحية و الغذاء الصحي
- أسريات
- 2 استراحة العيادة السورية
- المنتدى العام
- نشاطات و ترفيه
- 1 إسلاميات
- تطوير الذات و البرمجة اللغوية العصبية NLP
- المنتدى التقني
- مكتبة الصور و التصميم
- 1 المنتدى الثقافي و الأدبي
- المنتدى الرياضي
- منتدى اللغات Foriegn Languages
- الساحة العامة
- ساحة الحوار و النقاش
- ترحيب و تعارف
- قسم الاستشارات الطبية
- البحوث والندوات العلمية
- الاقتراحات و التطويرات
- الأقــســـام الــعـــامــة
- منتدى الحوار العام
- المواضيع العامة القديمة المستردة
- المواضيع الحاوية على مرفقات
الرئيسية › علم الصيدلة Pharma › علم الكيمياء Chemistry › الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
معايرات مطايفية اللهب
تم تعديل 2009/02/17 في الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
التحليل الآلي القسم العملي
· الغاية من التجربة:
1- التعرف على جهاز Flame Photometer وأجزائه وآلية عمله.
2- رسم السلاسل العيارية للعناصر : Na-K.
3- تحديد نسب العناصر السابقة في عينة ملح الطعام .
· الموجز النظري :
تمتلك الذرات أو الجزيئات سويات طاقة مكممة يدعى أخفضها بالسوية الأرضية
وعند تقديم طاقة كافية للجملة على شكل حراري أو إشعاع كهرطيسي , ترتفع طاقة الذرات أو الجزيئات إلى مستوى طاقي أعلى , تدعى هذه العملية بالتهييج , تميل الذرات أو الجزيئات المهيجة نحو العودة سريعا إلى المستوى الأرضي متخلصة من فائض طاقتها على شكل : ( حراري , إشعاع كهرطيسي أو كليهما ), وعندما يكون الناتج إشعاعا كهرطيسيا تكون طاقة كل فوتون صادر h مساوية إلى الفرق الطاقة بين السويتين , يعتمد مجال تواتر الإشعاعات الصادرة على طاقة مصدر التهييج .
الجهاز المستخدم FlamePhotometer410 بريطاني الصنع يتألف من : مدخنة- حامل المرشحات- حجرة ترذيذ- أنبوب شعري يشفط 4ml))في الدقيقة وهو المرذاذ- مخرج موصول بمضخة هواء – مخرج آخر للتزويد بالوقود المنزلي.
· آلية العمل :
يتم ترذيذ محلول العينة في حجرة الترذيذ وذلك بعد سحبها بالأنبوب الشعري .
يختلط جزء من الرذاذ مع الوقود والمؤكسد والفائض يتم صرفه عن طريق مصرف الجهاز .
ترجع الشوارد في اللهب إلى ذرات وتتهيج حراريا.
ما أن تغادر الذرات المهيجة النطاق الحراري الكافي لتهييجها حتى تعود لوضعها الطبيعي مصدرة حزمة طيفية تلون اللهب بلون يختلف من عنصر لأخر
تسقط الحزمة الطيفية الصادرة عن اللهب على المرشح الذي يقوم بتنقيتها من الأطوال الموجية غير المرغوبة ويسمح بمرور الخط الطيفي الطنيني الناتج عن انتقال الإلكترونات السطحية لذرات العنصر المراد تعيينه من السوية الأرضية إلى السوية الطاقية الأقرب وهو الانتقال الأكثر احتمالا (=589.6nm λ).تسقط الحزمة الطيفية النافذة من المرشح على الخلية الكهرضوئية فتحرض فيها تيارا كهربائيا شدته تتناسب شدته مع شدة الحزمة الطيفية المحرضة له , والذي يضخم لاحقا ويقاس على عداد الجهاز .
حيث:
I: شدة طيف الإصدار
C: تركيز المحلول
m:ميل الخط المستقيم
وهي علاقة خط مستقيم بين شدة طيف الإصدار وتركيز شوارد العنصر المعني في المحلول , يمر من المبدأ وميله m .
· تحضير الجهاز للعمل:
يشغل الجهاز(كبس الزر للمضخة وتأكد من فتح أنبوبة الغاز وتشغيل اللهب ) نتأكد من المرشحات الموضوعة لكل عنصر مراد تعيينه ثم نختبر سرعة الشفط , يوضع محلول الشاهد( Blank ) وتلغى شدة التيار العائد له أي التصفير على الشاهد , ثم نعاير الجهاز على أعلى تركيز من السلسلة المحضرة للعنصر.
نبدأ بقياس محاليل السلسلة بدءا من التراكيز المنخفضة وعند كل تركيز نأخذ عدة قراءات ونحسب المتوسط ثم نرسم المنحني المعياري (I=f(c)) والذي يجب أن يكون خطيا ونحسب ميل الخط لكل ستاندار من العلاقة ( m = I i / C i) ثم نحسب الميل الوسطي .
نمرر العينة بعد إمرار السلسلة العيارية للعنصر المدروس مباشرة ونأخذ عدة قراءات ونحسب الوسطي
تعتمد قراءات العينة عندما تقع ضمن خطية المنحني العياري الناتج . وعندها تكون قراءة العينة خارج مجال الخطية يجب تمديد العينة عدة مرات حتى تقع قراءتها ضمن الخطية المعتمدة . هذا ويؤخذ عدد مرات التمديد بعين الاعتبار لدى حساب تركيز العنصر المعني في العينة المدروسة .
القسم العملي
تحضير سلسلة عيارية مشتركة تحوي العناصر المدروسة ( standards ):
نحضر أولا ...
محلول أم لشوارد الصوديوم تركيزه (1000mg / l )
محلول أم لشوارد البوتاسيوم تركيزه: (1000mg / l )
- تحضير الستاندرات :

- و يكمل كل ستاندر حتى 100 ml ماء مقطر
- ونوجد التراكيز بعد التمديد بالعلاقة :
-
X V C X V = C
فيكون التركيز الجديد للصوديوم في الستاندرات الأربعة:

العلاقات المستخدمة في الحسابات:
I = m . C m =
- نحسب التركيز بـ ( mg/l ) من العلاقة :
C x =
- نحسب التركيز بـ ( ppm) من العلاقة :
Cmg/l * Vk *n
C ppm =
a
- التركيز المئوي: C % = C ppm .10-4
طريقة تحضير العينات :
نأخذ وزنتين من عينة ملح الطعام( NaCl):
الأولى a1 = 0.18الثانية a2 = 0.26
تحل كل أخيذة في الماء المقطر بدورق سعة 100 ml ثم نمدد حسب الحاجة
ثم نأخذ 2مل من دورق وتوضع في دورق أخر ونمدد حتى 100 ml
فيكون عدد مرات التمديد (مرة 100/2= 50)
تعيين نسبة الصوديوم ( Na ) :
بعد القيام بتشغيل الجهاز نقوم بتشغيل مرشح الصوديوم ونضبط الحساسية
ثم نبدأ بقياس شدة الإصدار للسلسة العيارية و العينات:
1 – السلسلة العيارية:
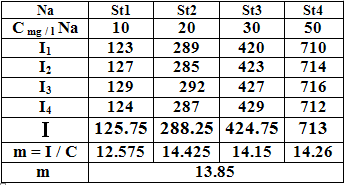
نرسم الخط البياني ما بين شدة الإصدار و التركيز
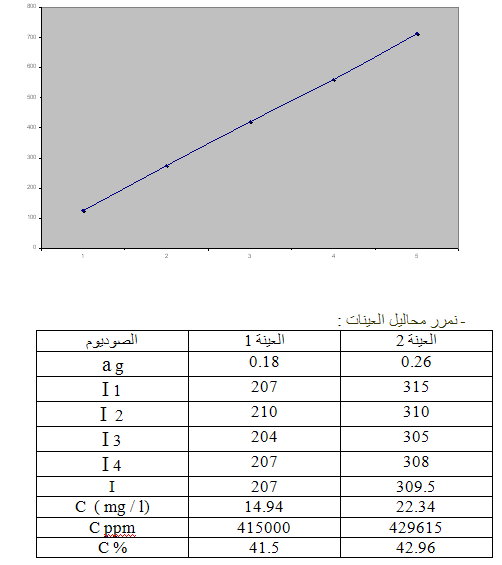
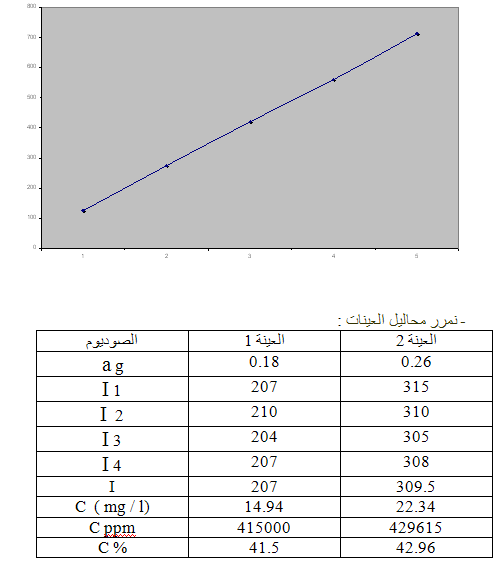
تعيين نسبة البوتاسيوم ( K ) :
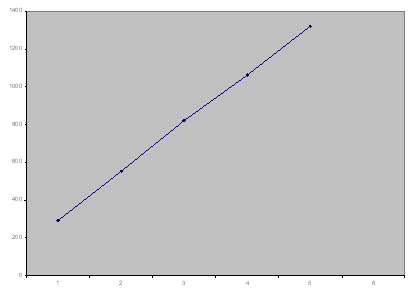
نقوم بتشغيل مرشح البوتاسيوم ونحسب قيمة شدة طيف الإصدار المتوسطة لكل ستندر ومن ثم نرسم العلاقة مابين I = f ( C ) ونحسب الميل الوسطي:
نرسم الخط البياني ما بين شدة الإصدار و التركيز كما يلي :
- نمرر محاليل العينات : ( عدد مرات التمديد = 1مرة)
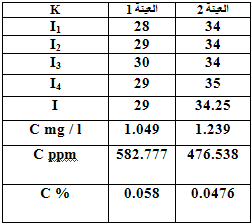
- ونقيس شدة الإصدار لها ونرتب النتائج وفق الجدول التالي :
· الغاية من التجربة:
1- التعرف على جهاز Flame Photometer وأجزائه وآلية عمله.
2- رسم السلاسل العيارية للعناصر : Na-K.
3- تحديد نسب العناصر السابقة في عينة ملح الطعام .
· الموجز النظري :
تمتلك الذرات أو الجزيئات سويات طاقة مكممة يدعى أخفضها بالسوية الأرضية
وعند تقديم طاقة كافية للجملة على شكل حراري أو إشعاع كهرطيسي , ترتفع طاقة الذرات أو الجزيئات إلى مستوى طاقي أعلى , تدعى هذه العملية بالتهييج , تميل الذرات أو الجزيئات المهيجة نحو العودة سريعا إلى المستوى الأرضي متخلصة من فائض طاقتها على شكل : ( حراري , إشعاع كهرطيسي أو كليهما ), وعندما يكون الناتج إشعاعا كهرطيسيا تكون طاقة كل فوتون صادر h مساوية إلى الفرق الطاقة بين السويتين , يعتمد مجال تواتر الإشعاعات الصادرة على طاقة مصدر التهييج .
الجهاز المستخدم FlamePhotometer410 بريطاني الصنع يتألف من : مدخنة- حامل المرشحات- حجرة ترذيذ- أنبوب شعري يشفط 4ml))في الدقيقة وهو المرذاذ- مخرج موصول بمضخة هواء – مخرج آخر للتزويد بالوقود المنزلي.
· آلية العمل :
يتم ترذيذ محلول العينة في حجرة الترذيذ وذلك بعد سحبها بالأنبوب الشعري .
يختلط جزء من الرذاذ مع الوقود والمؤكسد والفائض يتم صرفه عن طريق مصرف الجهاز .
ترجع الشوارد في اللهب إلى ذرات وتتهيج حراريا.
ما أن تغادر الذرات المهيجة النطاق الحراري الكافي لتهييجها حتى تعود لوضعها الطبيعي مصدرة حزمة طيفية تلون اللهب بلون يختلف من عنصر لأخر
تسقط الحزمة الطيفية الصادرة عن اللهب على المرشح الذي يقوم بتنقيتها من الأطوال الموجية غير المرغوبة ويسمح بمرور الخط الطيفي الطنيني الناتج عن انتقال الإلكترونات السطحية لذرات العنصر المراد تعيينه من السوية الأرضية إلى السوية الطاقية الأقرب وهو الانتقال الأكثر احتمالا (=589.6nm λ).تسقط الحزمة الطيفية النافذة من المرشح على الخلية الكهرضوئية فتحرض فيها تيارا كهربائيا شدته تتناسب شدته مع شدة الحزمة الطيفية المحرضة له , والذي يضخم لاحقا ويقاس على عداد الجهاز .
بما أن الحزمة الطيفية المحرضة تتناسب طردا مع عدد الذرات المثارة( N n)وفقا للعلاقة السابقة التي ولدتها , وعدد الذرات المثارة هذه التي ولدت الحزمة تتناسب مع تركيز المادة فأننا نحصل في المحصلة على تناسب طردي ما بين شدة التيار المتولد المقاس على الجهاز وتركيز الشاردة المدروسة في العينة أي أن :
I ~ N n ~ C >>>> I = m × C
I ~ N n ~ C >>>> I = m × C
حيث:
I: شدة طيف الإصدار
C: تركيز المحلول
m:ميل الخط المستقيم
وهي علاقة خط مستقيم بين شدة طيف الإصدار وتركيز شوارد العنصر المعني في المحلول , يمر من المبدأ وميله m .
· تحضير الجهاز للعمل:
يشغل الجهاز(كبس الزر للمضخة وتأكد من فتح أنبوبة الغاز وتشغيل اللهب ) نتأكد من المرشحات الموضوعة لكل عنصر مراد تعيينه ثم نختبر سرعة الشفط , يوضع محلول الشاهد( Blank ) وتلغى شدة التيار العائد له أي التصفير على الشاهد , ثم نعاير الجهاز على أعلى تركيز من السلسلة المحضرة للعنصر.
نبدأ بقياس محاليل السلسلة بدءا من التراكيز المنخفضة وعند كل تركيز نأخذ عدة قراءات ونحسب المتوسط ثم نرسم المنحني المعياري (I=f(c)) والذي يجب أن يكون خطيا ونحسب ميل الخط لكل ستاندار من العلاقة ( m = I i / C i) ثم نحسب الميل الوسطي .
نمرر العينة بعد إمرار السلسلة العيارية للعنصر المدروس مباشرة ونأخذ عدة قراءات ونحسب الوسطي
تعتمد قراءات العينة عندما تقع ضمن خطية المنحني العياري الناتج . وعندها تكون قراءة العينة خارج مجال الخطية يجب تمديد العينة عدة مرات حتى تقع قراءتها ضمن الخطية المعتمدة . هذا ويؤخذ عدد مرات التمديد بعين الاعتبار لدى حساب تركيز العنصر المعني في العينة المدروسة .
القسم العملي
تحضير سلسلة عيارية مشتركة تحوي العناصر المدروسة ( standards ):
نحضر أولا ...
محلول أم لشوارد الصوديوم تركيزه (1000mg / l )
محلول أم لشوارد البوتاسيوم تركيزه: (1000mg / l )
- تحضير الستاندرات :

- و يكمل كل ستاندر حتى 100 ml ماء مقطر
- ونوجد التراكيز بعد التمديد بالعلاقة :
-
X V C X V = C
فيكون التركيز الجديد للصوديوم في الستاندرات الأربعة:

العلاقات المستخدمة في الحسابات:
I = m . C m =
- نحسب التركيز بـ ( mg/l ) من العلاقة :
C x =
- نحسب التركيز بـ ( ppm) من العلاقة :
Cmg/l * Vk *n
C ppm =
a
- التركيز المئوي: C % = C ppm .10-4
طريقة تحضير العينات :
نأخذ وزنتين من عينة ملح الطعام( NaCl):
الأولى a1 = 0.18الثانية a2 = 0.26
تحل كل أخيذة في الماء المقطر بدورق سعة 100 ml ثم نمدد حسب الحاجة
ثم نأخذ 2مل من دورق وتوضع في دورق أخر ونمدد حتى 100 ml
فيكون عدد مرات التمديد (مرة 100/2= 50)
تعيين نسبة الصوديوم ( Na ) :
بعد القيام بتشغيل الجهاز نقوم بتشغيل مرشح الصوديوم ونضبط الحساسية
ثم نبدأ بقياس شدة الإصدار للسلسة العيارية و العينات:
1 – السلسلة العيارية:

نرسم الخط البياني ما بين شدة الإصدار و التركيز

تعيين نسبة البوتاسيوم ( K ) :
نقوم بتشغيل مرشح البوتاسيوم ونحسب قيمة شدة طيف الإصدار المتوسطة لكل ستندر ومن ثم نرسم العلاقة مابين I = f ( C ) ونحسب الميل الوسطي:

نرسم الخط البياني ما بين شدة الإصدار و التركيز كما يلي :

- نمرر محاليل العينات : ( عدد مرات التمديد = 1مرة)
- ونقيس شدة الإصدار لها ونرتب النتائج وفق الجدول التالي :
