مرحبا بك في هذا المنتدى !
يبدو أنك جديد هنا. إذا كنت تريد أن تتورط، انقر فوق أحد هذه الأزرار!
روابط سريعة
الأقسام
- 9.5K جميع الأقسام
- العلوم الطبية الأساسية Basic Medical Sciences
- علم التشريح العام و الجنين Anatomy and Embryology
- علم وظائف الأعضاء (الفيزيولوجيا) Physiology
- علم النسج Histology
- علم النسج العام ( عدا الأسنان ) General Histology
- علم النسج الخاص بالأسنان Oral histology
- علم الخليةو الحياة Biology
- علم التشريح المرضي Pathology
- التشريح المرضي العام ( عدا الأسنان ) Pathology
- التشريح المرضي الخاص بالأسنان Oral Pathology
- علم الأحياء الدقيقة Microbiology
- الجراثيم و الفيروسات Germs and Viruses
- الطفيليات الطبية Parasitology
- الفطور و الحشرات Insects and Fungi
- علم الوراثة الطبية Medical Genetics
- علم المناعة الطبية Medical Immunology
- 4 العلوم الطبية السريرية Clinical Medical Sciences
- الأمراض الداخلية Internal Medicine
- 4 الجراحة Surgery
- التوليد و الأمراض النسائية Gynacology & Obstetrics
- الصحة الجنسية Sexual Health
- طب الأطفال Pediatrics
- الجلدية Dermatology
- العينية Ophthalamology
- انف و أذن و حنجرة Ear, Nose, and Throat
- الطب المخبري labratory Medicine
- علم الأورام Oncology
- الطب الشرعي Forensic Medicine
- الطب النفسي Psychiatric
- التغذية والطب البديل Nourishments and Alternative Medicine
- طب الطوارئ و الإسعافات الأولية Emergency Medicine And Primary aids
- متلازمات طبية Medical Syndromes
- علم الأشعة Radiology
- طب الأسنان Dental Medicine
- التعويضات المتحركة الكاملة و الجزئية Removable Prothodontics
- المداواة الترميمية operative dentistry
- المداواة اللبية Endodontics
- طب أسنان الأطفال Pediatric Dental
- جراحة الوجه والفكينoral surgery
- التعويضات الثابتة Fixed Prothodontics
- المواد السنية dental materials
- النسج حول السنية periodontology
- التقويم Orthodontics
- منتدى فنيي الأسنان dental technicians
- طب الفم العام general oral medicine
- علم الأشعة Radiology
- حالات سريريةClinical Cases
- أخر مستجدات طب الأسنان last news
- المنتدى الطبي السني العامgeneral dentistry
- علم الصيدلة Pharma
- علم الأدوية
- علم الأدوية Pharmacology
- أدوية الطوارئ Emergency drugs
- المضادات الحيوية Antibiotics
- الأدوبة المسببة للتشوهات الجنينية Teratogenic drugs
- أدوية Drugs
- علم الكيمياء Chemistry
- كيمياء حيوية سريرية Clinical Biochemistry
- الكيمياء العامة و العضوية و الفيزيائية General & organic chemistry & physical
- الكيمياء الحيوية Biochemistry
- الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
- علم عقاقير Pharmacognosy
- الطب البديل Alternative Medicine
- علم الأعشاب الصيدلانية Pharmaceutical Herbs
- التكنولوجيا الصيدلية Pharmatical technology
- الصيدلانيات Pharmaceutics
- الصيدلة الحيوية والحرائك الدوائية Biopharmaceutics & Pharmacokinetics
- الصناعة الدوائية Drug Industry
- علم السموم Toxicology
- الوصفات الطبية Prescriptions
- صيدلية المجتمع و أدوية OTC Medicines OTC
- الكيمياء الصيدلية Pharmaceutical chemistry
- الصيدلة سريرية و صيدلية المشافي Clinical & Hospital Pharmacy
- دمويات و مناعيات hematology & immunology
- مراقبة جودة الأدوية Drug Quality Control
- البيولوجيا الجزيئية Molecular Biology
- الصحة العامة و تلوث البيئة General Health
- المنتدى الصيدلاني العام
- الجودة الغذائية Food quality
- قسم الجودة الطبية Department of Medical Quality
- قسم الجودة العام General Quality Department
- قسم السلامة والصحة المهنية Department of Occupational Safety and Health
- قسم جودة وسلامة الأغذية Department of Food Quality and Safety
- المنتدى الطبي العام
- المنتدى الطبي العام
- منتدى العلوم والتكنولوجيا الطبية Medical Technology
- قانون و أخلاقيات المهنة
- تاريخ و آداب الطب
- الدراسات العليا و الدراسة في الخارج
- امتحانات Medical Exams
- تبادل الكتب الطبية و الميديا و البيانات الطبية
- مواضيع طبية غير مصنفة
- قسم الأسرة و المجتمع
- العناية بالمرأة الحامل و المرضع
- تربية الأطفال
- الصحة العامة
- التغذية الصحية و الغذاء الصحي
- أسريات
- 2 استراحة العيادة السورية
- المنتدى العام
- نشاطات و ترفيه
- 1 إسلاميات
- تطوير الذات و البرمجة اللغوية العصبية NLP
- المنتدى التقني
- مكتبة الصور و التصميم
- 1 المنتدى الثقافي و الأدبي
- المنتدى الرياضي
- منتدى اللغات Foriegn Languages
- الساحة العامة
- ساحة الحوار و النقاش
- ترحيب و تعارف
- قسم الاستشارات الطبية
- البحوث والندوات العلمية
- الاقتراحات و التطويرات
- الأقــســـام الــعـــامــة
- منتدى الحوار العام
- المواضيع العامة القديمة المستردة
- المواضيع الحاوية على مرفقات
الرئيسية › علم الصيدلة Pharma › علم الكيمياء Chemistry › الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
المعايرات الكمونية
تم تعديل 2009/02/17 في الكيمياء التحليلية و التحليل الآلي Analytical chemistry and the automated analysis
أولاً : معايرة حمض قوي ( HCl) بأساس قوي ( NaOH) 0.01N:
نأخذ من محلول الحمض 25ml و نضعه في بيشر و نغمس المسرى الزجاجي فيه و نقيس كل من درجة الحموضة و فرق الكمون عند كل إضافة من محلول ماءات الصوديوم الموجود في السحاحة .
نسجل النتائج:
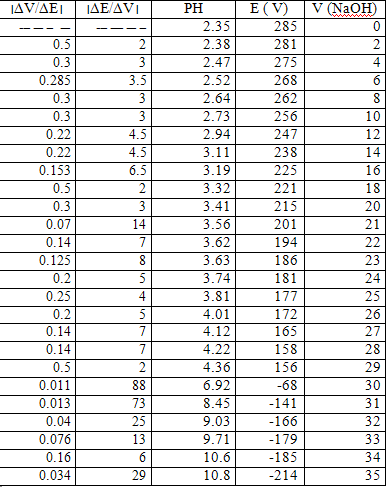
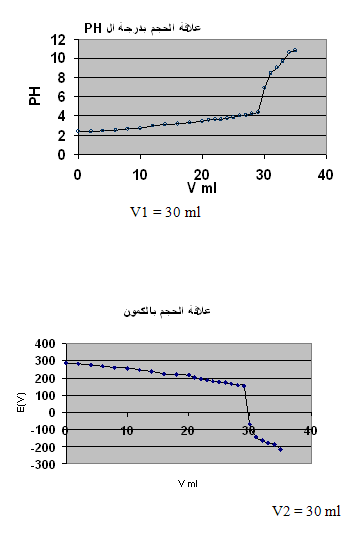
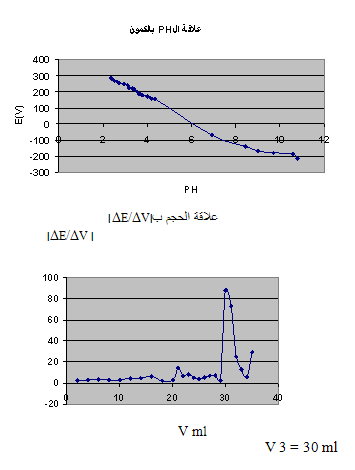
نوجد من الرسم الحجم اللازم للوصول لنقطة التكافؤ و منه نحسب تركيز الحمض
من العلاقة:
و بأخذ المتوسط الحسابي للحجوم نجد أن:
30 + 30 + 30
V eq =
= 30 ml
3
نعوض :
ثانيا :معايرة حمض ضعيف (CH3COOH ) بأساس قوي (NaOH ) معلوم التركيز (0. 1N):
نضع 25 مل من حمض الخل CH3COOH في بيشر نغمس المسرى الزجاجي فيه و نقيس كل من درجة الحموضة و فرق الكمون عند كل إضافة من محلول ماءات الصوديوم الموجود في السحاحة .
النتائج:
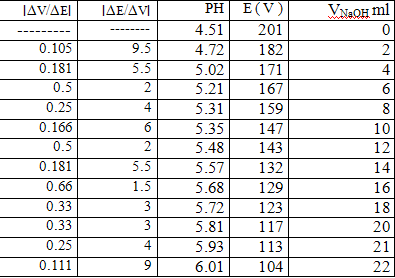
الرسم البياني:
1) علاقة الحجم بـ PH

2) علاقة الحجم بالكمون:

- الرسم الحجم اللازم للوصول لنقطة التكافؤ و منه نحسب تركيز الحمض
من العلاقة:
و بأخذ المتوسط الحسابي للحجوم نجد أن:
V eq = 31
N × 25 = 0.1 × 31 → N = 0.124 N
- حساب ثابت تشرد الحمض الضعيف:
عند معايرة حمض الخل بماءات الصوديوم حصلنا على جملة موقية حمضية (حمض الخل و خلات الصوديوم ) حيث يعطى قانون ال PH لهذه الجملة بالعلاقة:
- الغاية من التجربة:
1) تحديد نقاوة عينة من حمض الكبريت :
2) تحديد نقاوة عينة من كربونات الصوديوم .
- مقدمة نظرية :
كربونات الصوديوم Na2CO3 تملك وظيفتين أساسيتين لذا لها نقطتي
تكافؤ حيث تعاير على مرحلتين:
Na2CO3 + HCl → NaHCO3 + NaCl
NaHCO3 + HCl → H2CO3 + NaCl
أما حمض الكبريت فيبدي قفزة واحدة على الرغم من احتوائه على وظيفتين حمضيتين بسبب صغر ثابت تشرد الوظيفة الحمضية الأولى.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
1- معايرة حمض قوي ( H2SO4) بأساس قوي (NaOH) معلوم التركيز ( 0.1 ).
أ – لتحضير محلول الحمض نأخذ ( ( 2.5ml من H2SO4 و نمددها حتى
25ml في دورق معايرة و نضعه في بيشر ,
عدد مرات التمديد = 25 مرة
- لتحضير محلول الأساس نأخذ 25ml من NaOH ونمددها حتى 250ml
في الدورق و نضعه في السحاحة :
عدد مرات التمديد = 25 مرة
نغمس المسرى الزجاي في البشر الحاوي على الحمض ونقيس كل من
الـ PH و E عند كل إضافة من الأساس ونسجل النتائج :
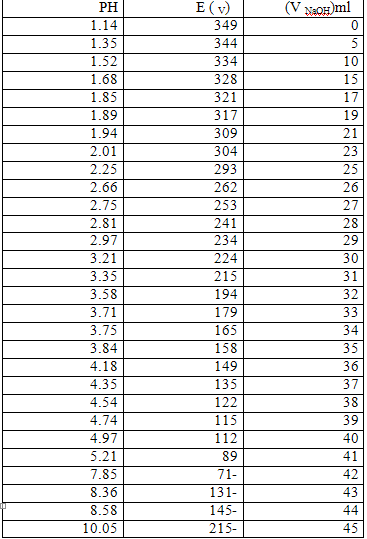
رسم الخطوط البيانية :
1) علاقة الحجم بـ PH
2) علاقة الحجم بالكمون:
3) علاقة الكمون بـ PH
نوجد من الرسم الحجم اللازم للوصول لنقطة التكافؤ و منه نحسب تركيز الحمض
من العلاقة:
و بأخذ المتوسط الحسابي للحجوم نجد أن:41.5 ملVeq =
تحليل عينة من كربونات الصوديوم:
نزن 0.2 غ من كربونات الصوديوم وننقلها لدورق 100 مل و نحلها بالماء المقطر حتى تمام الانحلال ونكمل بالماء المقطر حتى العلام .
نأخذ 25 مل من المحلول الناتج إلى بيشر ونعايرها بحمض كلور الماء.
النتائج:
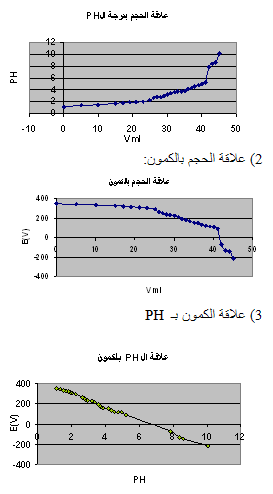
الرسم البياني :
1) علاقة الـ PH بالحجم :
2) علاقة الحجم بالكمون :
3) علاقة الـ PH بالكمون :
الحسابات: a = 0.2 gr
من المنحنيات نستنتج أن الحمض عدل كل وظيفة أساسية لوحدها
فالحجوم اللازمة للمعايرة هي :
Veq = 8.87 ml
نأخذ من محلول الحمض 25ml و نضعه في بيشر و نغمس المسرى الزجاجي فيه و نقيس كل من درجة الحموضة و فرق الكمون عند كل إضافة من محلول ماءات الصوديوم الموجود في السحاحة .
نسجل النتائج:



نوجد من الرسم الحجم اللازم للوصول لنقطة التكافؤ و منه نحسب تركيز الحمض
من العلاقة:
(NV)HCl = (NV)NaOH
و بأخذ المتوسط الحسابي للحجوم نجد أن:
30 + 30 + 30
V eq =
= 30 ml
3
نعوض :
N×25 = 0. 1× 30 →N = 0. 12 n
ثانيا :معايرة حمض ضعيف (CH3COOH ) بأساس قوي (NaOH ) معلوم التركيز (0. 1N):
نضع 25 مل من حمض الخل CH3COOH في بيشر نغمس المسرى الزجاجي فيه و نقيس كل من درجة الحموضة و فرق الكمون عند كل إضافة من محلول ماءات الصوديوم الموجود في السحاحة .
النتائج:

الرسم البياني:
1) علاقة الحجم بـ PH

2) علاقة الحجم بالكمون:

- الرسم الحجم اللازم للوصول لنقطة التكافؤ و منه نحسب تركيز الحمض
من العلاقة:
N . V)CH3COOH = (N . V)NaOH )
و بأخذ المتوسط الحسابي للحجوم نجد أن:
V eq = 31
N × 25 = 0.1 × 31 → N = 0.124 N
- حساب ثابت تشرد الحمض الضعيف:
عند معايرة حمض الخل بماءات الصوديوم حصلنا على جملة موقية حمضية (حمض الخل و خلات الصوديوم ) حيث يعطى قانون ال PH لهذه الجملة بالعلاقة:
PH = PKa + log (CCH3COOH/ CCH3COO-)
لكن عند منتصف المعايرة يكون مقدار ما ينتج من الملح مساويا لما يستهلك من الحمض المتفاعل مع الأساس و بالتالي :
CCH3COOH = CCH3COO-
CCH3COOH/ CCH3COO- = 1
log (CCH3COOH/ CCH3COO-) = 0
فتصبح العلاقة عند منتصف المعايرة هي:CCH3COOH/ CCH3COO- = 1
log (CCH3COOH/ CCH3COO-) = 0
PH1/2 = PKa
PH1/2
Ka = 10
نستنتج قيمة PH1/2 من خلال الرسم البياني فنجد :Ka = 10
PH1/2 = 4.95
-4.95
Ka = 10
-5
Ka = 1.122× 10
-4.95
Ka = 10
-5
Ka = 1.122× 10
تحليل عينات باستخدام تقنية المعايرات الكمونية
- الغاية من التجربة:
1) تحديد نقاوة عينة من حمض الكبريت :
2) تحديد نقاوة عينة من كربونات الصوديوم .
- مقدمة نظرية :
كربونات الصوديوم Na2CO3 تملك وظيفتين أساسيتين لذا لها نقطتي
تكافؤ حيث تعاير على مرحلتين:
Na2CO3 + HCl → NaHCO3 + NaCl
NaHCO3 + HCl → H2CO3 + NaCl
أما حمض الكبريت فيبدي قفزة واحدة على الرغم من احتوائه على وظيفتين حمضيتين بسبب صغر ثابت تشرد الوظيفة الحمضية الأولى.
H2SO4 + 2NaOH → Na2SO4 + 2H2O
القسم العملي:
1- معايرة حمض قوي ( H2SO4) بأساس قوي (NaOH) معلوم التركيز ( 0.1 ).
أ – لتحضير محلول الحمض نأخذ ( ( 2.5ml من H2SO4 و نمددها حتى
25ml في دورق معايرة و نضعه في بيشر ,
عدد مرات التمديد = 25 مرة
- لتحضير محلول الأساس نأخذ 25ml من NaOH ونمددها حتى 250ml
في الدورق و نضعه في السحاحة :
عدد مرات التمديد = 25 مرة
نغمس المسرى الزجاي في البشر الحاوي على الحمض ونقيس كل من
الـ PH و E عند كل إضافة من الأساس ونسجل النتائج :

رسم الخطوط البيانية :
1) علاقة الحجم بـ PH
2) علاقة الحجم بالكمون:
3) علاقة الكمون بـ PH

نوجد من الرسم الحجم اللازم للوصول لنقطة التكافؤ و منه نحسب تركيز الحمض
من العلاقة:
(N . V)H2SO4 = (N . V)NaOH
و بأخذ المتوسط الحسابي للحجوم نجد أن:41.5 ملVeq =
N × 25 = 0.1 × 41.5→ N = 0.166 n
تحليل عينة من كربونات الصوديوم:
نزن 0.2 غ من كربونات الصوديوم وننقلها لدورق 100 مل و نحلها بالماء المقطر حتى تمام الانحلال ونكمل بالماء المقطر حتى العلام .
نأخذ 25 مل من المحلول الناتج إلى بيشر ونعايرها بحمض كلور الماء.
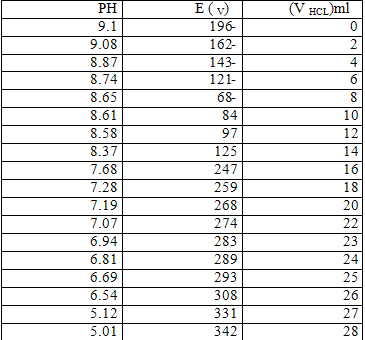
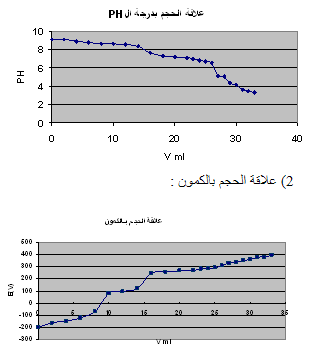
النتائج:

الرسم البياني :
1) علاقة الـ PH بالحجم :
2) علاقة الحجم بالكمون :
3) علاقة الـ PH بالكمون :

الحسابات: a = 0.2 gr
من المنحنيات نستنتج أن الحمض عدل كل وظيفة أساسية لوحدها
فالحجوم اللازمة للمعايرة هي :
Veq = 8.87 ml
(NV)HCl = (NV) Na2CO3
0.1 × 8.87 = N × 25
N = 0.035 n
نحسب نقاوة عينة كربونات الصوديوم من العلاقة:
0.1 × 8.87 = N × 25
N = 0.035 n
X% = <(NV)HCl/VNa2CO3> × ENa2CO3×<100/1000>×VK/a
X% = 0.035 × 53 × 0.1 × 100/0.2
X% = 92.75
X% = 0.035 × 53 × 0.1 × 100/0.2
X% = 92.75