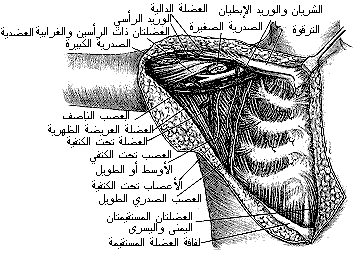
معالجة سرطان الثدي TREATMENT OF CANCER BREASTتعتمد المعالجة كما أشير له سابقًا على مرحلة المرض السريرية عند ظهوره، ولا يشمل ذلك تحديدَ المرحلة التقليدي وع ن TNM فقط بل يشمل أيضًا خصائصَ ورميةً أخرى مثل درجة الورم. وتشمل معالجة سرطان الثدي المبكر عادة الجراحة مع المداواة بالأشعة أو من دونها. ويضاف العلاج المجموعي مثل العلاج الكيماوي أو العلاج الهرموني إذا كانت هناك عوامل إنذارية معاكسة مثل غزو العقد اللمفية التي تشير إلى احتمال حدوث نكسة نقيلية. وفي الطرف الآخر من الطيف العلاجي، يعالج المرض المتقدم موضعيًا أو المرض النقيلي عادة، بعلاج مجموعي لتلطيف palliate الأعراض، بينما تلعب الجراحة دورًا أصغر بكثير. طريقة الفريق المتعدد التخصصات The multidisciplinary team approach. يساعد التواصل الجيد بين الطبيب ومريضته، كما هو الحال في جميع فروع الطب، في تبديد قلقها. كما أن مساهمة المريضة في أخذ القرارات العلاجية في غاية الأهمية في سرطان الثدي عندما ينعدم اليقين حول أفضل الاختيارات العلاجية وكانت هناك رغبة في معالجة المريضة ضمن بروتوكول (نظام) تجربة سريرية منضبطة controlled clinical trial. ومن المفيد، كجزء من المعالجة قبل الجراحة وبعدها، الاستعانة بخبرات مستشار مدرَّب في أمراض الثدي للحصول على النصيحة المتوافرة حول بدائل الثدي breast prostheses والدعم النفسي والمعالجة الفيزيائية حسبما يكون مناسبًا. وتقدم العناية إلى مريضة سرطان الثدي في كثير من المراكز المتخصصة كمشروع مشترك بين الجراح واختصاصي الأورام واختصاصي المداواة بالأشعة والهيئات الطبية المساندة، مثل الممرضة السريرية المختصة. معالجة المرض المبكر Treatment of early disease والأهداف هي: · "الشفاء" - وهذا ممكن في بعض المريضات، ولكن الرجعة بعد ما يصل إلى 20 عامًا ليست نادرة. · السيطرة على المرض الموضعي في الثدي والإبط. · المحافظة على الوظيفة والشكل. · منع حدوث النقائل البعيدة أو تأخيره. وتتحقق السيطرة الموضعية local control بواسطة الجراحة و/أو المداواة بالأشعة. الجراحة Surgery مازال دورها مركزيًا في معالجة سرطان الثدي، ولكن أصبح هناك تحول تدريجي نحو الأساليب المتحفظة أكثر، المدعومة بالتجارب العلاجية التي بينت وجود كفاءة متساوية بين استئصال الثدي mastectomy والاستئصال الموضعي local excision الذي تعقبه المداواة بالأشعة. ولقد جاء ذلك عقب تغير نمط انتشار سرطان الثدي الذي لم يَعُدْ يُحْسَب أنه انتشار تشريحي نابذ centrifugal anatomical spread وإنما هو وجود نقائل صغرية (مجهرية) micrometasases منقولة بالدم تحدد النتيجة المسبقة للمرض. وكان يؤمل في البداية أن يساعد الابتعاد عن استئصال الثدي في تبديد المراضة النفسية الكبيرة لسرطان الثدي، ولكن الدراسات الحديثة أظهرت أن ما يزيد على 30 بالمائة من النساء أُصِبْنَ بقلق واكتئاب شديدين بعد الجراحتين الجذرية radical والتحفظية جميعًا. وتنحو المريضات إلى القلق حول تأثير الجرحة على مظهرهن وعلاقاتهن بعد استئصال الثدي، بينما يبقين خائفات من رجعة المرض بعد الجراحة التحفظية. استئصال الثدي Mastectomy يُسْتَدْعَى الآن بشكل صارم في الأورام الكبيرة (بالنسبة لحجم الثدي)، أو الأورام المركزية تحت الحلمة أو التي تشملها، أو المرض المتعدد البؤرات، أو الرجعة الموضعية، أو حسب رغبة المريضة. ولم تَعُدْ تستدعى عملية هولستيد* لاستئصال الثدي التي تشمل استئصال الثدي مع العقد اللمفية الإبطية والعضلتين الصدرية الكبيرة pectoralis major والصدرية الصغيرة pectoralis minor معًا لأنها تُحْدِثُ مراضة كبيرة من دون تحسن في البقيا survival. وتجرى عملية استئصال الثدي المعدَّل (باتي) بشكل شائع أكثر وستوصف العملية لاحقًا. استئصال الثدي، عملية باتي* Patey mastectomy . يسلخ الثدي والبنيات المرافقة جملة en bloc (انظر الشكل 39-34)، وتتألف الكتلة المستأصلة من: · الثدي كله. · جزء كبير من الجلد يقع مركزه فوق الورم ولكنه يشمل الحلمة دائمًا. · جميع الشحم واللفافة fascia والعقد اللمفية في الإبط. والصدرية الصغيرة، إما تُقطَع أو تُستأصل حتى يتم الوصول إلى ثلثي الإبط العلويين. ويجب المحافظة على الوريد الإبطي وعصبي المنشارية الأمامية serratus anterior والعريضة الظهرية latissimus dorsi. ويُنْزَح الجرح باستعمال أنبوب ماص واسع.
ويُشَجَّع تحريك الذراع مبكرًا وتساعد المعالجة الفيزيائية في استعادة الوظيفة سريعًا - وتستطيع معظم المريضات العودة إلى أعمالهن الخفيفة في البيت خلال بضعة أسابيع. استئصال الثدي الجذري Radical mastectomy. مازال كثير من الجراحين في أنحاء العالم يمارسون الجراحة في مناطق لا توجد فيها أجهزة للمداواة بالأشعة أو أدوية حديثة (حتى لو استطاع المريض أن ينفق عليها). وتبقى عملية استئصال الثدي الجذري طريقة مهمة في المعالجة الجراحية (الشكل 39-34). وفيها يُسلَّخ الثدي وبنياته المرافقة جملةً en bloc، وتتألف الكتلة المستأصلة من: · الثدي كلِّه. · جزء كبير من الجلد، يقع مركزُه فوق الورم، ويحتوي الحلمةَ دائمًا. وعندما تكون إصابة الجلد أكثر اتساعًا، يجب التضحية بجزء أكبر منه. · الدهن واللفافة fascia من حافة الترقوة السفلية حتى ربع غمد البطنية المستقيمة rectus abdominis sheath ويتضمنه، ومن القصِّ sternum حتى الحافةِ الأمامية للعريضة الظهرية latissimus dorsi. · جزء الصدرية الكبيرة pectoralis major القصِّي وغمدها اللفافي. · الصدرية الصغيرة وغمدها اللفافي. · الغشاء الضلعي الغرابي costocoracoid. · جميع الدهن واللفافة والعقد اللمفية في الإبط. · اللفافة فوق الجزء الأمامي مع أجزاء العضلات الأمامية للمائلة الظاهرة external oblique، والمنشارية الأمامية serratus anterior، وتحت الكتفية subscapularis، والجزء المكشوف من العريضة الظهرية، والجزء الأعلى من المستقيمة البطنية (الشكل 39-34). ويجب بذل كل جهد في أثناء العملية للحفاظ على: · الوريد الإبطي axillary vein. · الوريد الرأسي cephalic vein. · عصب بيلّ* الصدري الطويل long thoracic nerve of Bell (عصب المنشارية الأمامية). ويمكن التضحية بالعصب تحت الكتف subscapularالأوسط أو الطويل (عصب العريضة الظهريةlatissimus dorsi ) من دون تأثيرات ضارة، ويجب تنفيذ ذلك بلا تردد إذا كان قطعُه يضمن تنفيذ تسليخ أوفى. ويُنزَح الجرح عند الانتهاء من العملية، ويفضل استعمال أنبوب واسع للمص. وإذا تمت التضحية بمنطقة جلدية واسعة، فقد لا يكون تقريبُ حافتي الجلد ممكنًا تمامًا، إذ يبقى في الجلد عَوَزٌ يمكن معالجته بتطعيمه grafting مباشرةً أو فيما بعد. وتسند الذراع بعد العملية على وسادة حتى يشفى الجلد، عندئذ تُشجَّع المريضة على الحركة المبكرة. وحركة الذراع، بعد خسارة العضلات الواسعة هذه، جيدة بصورة مدهشة.
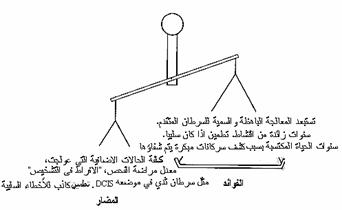
جراحة سرطان الثدي التحفظية Conservative cancer breast surgery تهدف إلى استئصال الورم مع إطار من نسيج الثدي السوي يبلغ 1 سم على الأقل. وهذا يدعى عادة استئصال موضعي واسع أو استئصال الكتلة lumpectomy. ويشمل استئصال ربع الثدي quadrantectomy استئصال قطعة الثدي التي تحتوي الورم كلها. وتتضمن هذه العمليات جراحة الإبط، عادة من خلال شقٍّ منفصل في الإبط، حتي يمكن إما اعتيان sampling العقد اللمفية أو نزع العقد خلف الصدرية الصغيرة pectoralis minor (مستوى 2) أو إجراء تسليخ إبطي تام (مستوى 3). ويعرف استئصال الربع quadrantectomy مع تسليخ الإبط axillary dissection والمداواة بالأشعة radiotherapy باسم QUART وقد روج له فيرونيزي*. وبالرغم من أنه معروف إلى حدٍّ ما أن هناك نسبة أعلى من الرجعة الموضعية عقب الجراحة التحفظية، حتى لو رافقتها المداواة بالأشعة، فإن النتيجة الطويلة الأمد بالنسبة للبقيا survival لا تتغير. دور جراحة الإبط The role of axillary surgery مازال مثارًا للجدل، ولكن من المقبول أن وجود مرض نقيلي في داخل العقد اللمفية الإبطية لايزال أفضل واسم للإنذار. ومع ذلك لا تؤثر معالجة الإبط في البقيا على المدى الطويل، مما يوحي بأن العقد الإبطية لا تعمل بوصفها خزانـًا للمرض بل كواسم للقدرات النقيلية. ومن الطرق المقبولة لهذه المشكلة في النساء قبل الإياس أن تـُحدَّدَ المرحلة بالجراحة لأن هناك دعوى جيدة لإعطاء العلاج الكيماوي إلى المريضات المصابات بعقد لمفية إيجابية. أما في المريضات بعد الإياس، فيعطى التاموكسيفين عادة بغض النظر عن حالة العقد اللمفية الإبطية. ويبدو من المعقول إذا أُجري استئصال الثدي تنظيف الإبط كجزء من الجراحة، ولكن إذا كان من المخطط إجراء استئصال موضعي واسع، فللجراح أن يختار التسليخ الجراحي أو المداواة بالأشعة بعد الجراحة. ويجب ألا يتم الجمع بين جراحة الإبط والمداواة بالأشعة بسبب المراضة المتزايدة. وليس هناك ضرورة لاستئصال العقد اللمفية الثديية الداخلية internal mammary. المداواة بالأشعة Radiotherapy الموجهة إلى جدار الصدر بعد استئصال الثدي قد تم التخلي عنها بشكل عام إلا في حالات المرض الموضعي الواسع مع ارتشاح جدار الصدر. ومن الأمور التقليدية أن يتم الجمع بين الجراحة التحفظية ومداواة نسيج الثدي المتبقي بالأشعة. ومع ذلك، هناك شك يدور الآن حول جميعِ المريضات اللاتي تعرضن لجراحة تحفظية، إذا كان من الواجب مداواتهن بالأشعة، لأن الرجعة الموضعية لا تنشأ عند معظمهن، وبذلك تشكل مساعدتهن بالمداواة بالأشعة علاجًا مفرطًا، وهذا لا يَعْدِم المراضة morbidity (وحتى الوفاة على المدى الطويل) من تشعيع عضلة القلب غير المقصود. وتجرى الآن تجربة سريرية وطنية في المملكة المتحدة في محاولة لإثبات إذا ما كان هناك فائدة بالنسبة للبقيا باستعمال المداواة بالأشعة، ولتعيين من هن المريضات اللاتي لديهن أعلى نسبة من خطورة الانتكاس الموضعي، وبذلك يستفدن أكثر ما يمكن من مداواة الثدي بالأشعة بعد الجراحة. ويُعتقد الآن أن أولئك اللاتي يقعن ضمن الخطورة العالية يشملن أولئك اللاتي لديهن سرطان واسع في موضعه in situ (أو بالطبع سرطان غازي) في هوامش الاستئصال، والمريضات تحت سن 35 عامًا، وأولئك المصابات بمرض متعدد البؤرات. العلاج المجموعي المساعد Adjuvant systemic chemotherapy. لقد حدثت ثورة في فهمنا لطبيعة سرطان الثدي الحيوية عبر السنوات العشرين الأخيرة. وأصبح يمكن الآن بشكل واسع، أن تحدِّد نتائج المعالجة مسبقًا بمعرفة حجم المرض النقيلي المجهري الموجود عند التشخيص. والتباين في مدى اتساع العلاج الموضعي الجذري، قد يؤثر في الانتكاس الموضعي ولكنه على الأرجح لا يغير معدل الوفاة من المرض على المدى الطويل. ومع ذلك، يمكن أن يتوقع إذا وُجِّهَ العلاج المجموعي نحو النقائل الصغرية (المجهرية) micrometastases المزعومة أن يؤخر النكسة ويطيل البقيا. ونتيجة للتجارب السريرية الدولية العديدة والتحليل العالمي الشامل التي أجريت أخيرًا، يمكن القول بثقةٍ تدعمها إحصائيات كبيرة، إن الاستخدام المناسب للعلاج الكيماوي المساعد، يحسِّن البقيا survival الخالية من الانتكاسِ بمقدار 30 بالمائة تقريبًا، وذلك بالنهاية يُترجَم إلى تحسُّن البقيا الكلية تحسُّنًا مطلقًا بحدود 10 بالمائة بعد 10 سنوات. واذا وضعنا في اعتبارنا درجة انتشار المرض في أوروبا الشمالية والولايات المتحدة، فإن هذا يُترجَم إلى أرقامٍ لها أهميةٌ صحية شعبية كبيرة. من التي تـُعالـَج وبماذا Who to treat and with what ما يزالان سؤالين لم يتم الوصول إلى أجوبة ثابتة عليهما بعد، ولكن المعلومات المجملة من التجارب السريرية توحي بأن النساء قبل الإياس، المصابات بعقد لمفية إيجابية، يجب أن يوصى بمعالجتهن بعلاج كيماوي مساعد، وأن النساء بعد الإياس يستفدن استفادة مجدية من 20 مغم تاموكسيفين يوميًا لمدة سنتين. العلاج الهرموني Hormone therapy. التاموكسيفين هو أكثر معالجة هرمونية تستعمل بشكل واسع في سرطان الثدي. وقد تم نشر أول تقارير عن كفاءته كعلاج مساعد عام 1985. وقد ثبت الآن أنه يقلل معدل الرجعة السنوية بـ 25 بالمائة مع تخفيض معدل الوفاة السنوية بـ 17 بالمائة. وتأثير التاموكسيفين مفيد بغض النظر عن وضع مستقبلات الاستروجين، بالرغم من أن النساء المصابات بأورامٍ غنيةٍ بمستقبلاتِ الاستروجين، قد يحققن فائدة أكبر فيما يتعلق بخطورة الانتكاسة النسبية. وقد تم ملاحظة التأثيرات المفيدة بالنسبة لرجعة الورم ومنع أورام الثدي المقابل في النساء قبل الإياس، كما لوحظ أن سنتين من المعالجة ربما تفيد المريضة حتى مدة 10 سنوات أو أكثر. ولقد قاربت الدراسات التي تبحث فترة المعالجة المثلى على الانتهاء. ويتم تطوير أدوية هرمونية أخرى ربما تثبت فائدتها كعلاج مساعد، مثل شوادِّ محررةِ هرمونِ اللوتنة lutenizing hormone releasing hormone agonists (LHRH) التي تُحْدِثُ كبتًًا مبيضيًا يمكن عكسه reversible، وهكذا يؤمل أن يكون لها تأثير مفيد مثل اجتثاث المبيض جراحيًا أو شعاعيًا في النساء قبل الإياس. العلاج الكيماوي Chemotherapy بإعطاء دورات لستة أشهر من سيكلوفوسمايد وميثوتريكسات و5-فلورويوراسيل (CMF)[1] يحقق انخفاضًا في خطورة الانتكاس يعادل 30 بالمائة خلال 10 سنوات. وقد اقتصرت هذه المعالجة على النساء قبل الإياس المصابات بعقد لمفية إيجابية (حيث يكون تأثيرُه جزئيًا على الأرجح تأثيـرَ خِصاءٍ castration كيماوي)، ولكن يوصى به بشكل متزايد للنساء بعد الإياس ذوات الإنذار المرضي السيء. وقد يؤخذ العلاج الكيماوي بعين الاعتبار في مريضات لديهن عقد لمفية سلبية إذا كانت عوامل الإنذار الأخرى مثل درجة المرض تنبيء بخطورة رجعة عالية. وتأثير الجمع بين العلاجين الهرموني والكيماوي مايزال قيد البحث. ويستعمل العلاج الكيماوي الأولي في بعض المراكز في الأورام الكبيرة التي تحتمل الجراحة operable وتحتاج إلى استئصال ثدي تقليدي (وعلاج كيماوي بعد العملية بدرجة يقينية تقريبا). وتهدف هذه المعالجة إلى أن ينكمش الورم ليصبح إجراء جراحة الصدر التحفظية ممكنًا.
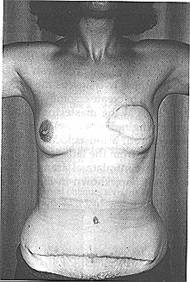
ترميم الثدي Breast reconstruction بالرغم من الاتجاه نحو الجراحة التحفظية، مازال ما يقرب من 50 بالمائة من النساء بحاجة إلى استئصال ثدي أو يرغبن فيه. ويمكن أن يُجْرَى لهؤلاء النساء تقويمُ ثديٍ مباشرٍ أو متأخر. وهناك عدد قليل من موانع استعمال تقويم الثدي؛ وحتى أولئك اللاتي لديهن توقع محدود للحياة قد يستفدن من تحسين نوعيتها. ومع ذلك تحتاج المريضات إلى النصح قبل العملية حتى لا تكون توقعاتهن للنتيجة المزوِّقة غير واقعية. وأكثر أنواع التقويم هو استعمال غرسة من هلامة سيليكون silicone gel يسبقها توسيع الأنسجة باستعمال بديل ملحي يتوسع expandable saline prosthesis أولاً (أو جهاز يجمع هذين الاثنين مثل بديل بيكر Becker prosthesis (الشكل 39-35)) الذي يسبب توسع الثدي الجديد. واذا كان موقع استئصال الثدي الجلدي سيئًا (مثلا عقب المداواة بالأشعة) أو كان هناك حاجة لحجم أكبر من الأنسجة، يمكن تصميم سديلة عضلية جلدية musculocutaneous flap من العضلة الظهرية العريضة latissimus dorsi (LD flap) أو العضلة البطنية المستعرضة بالجانب الآخرtransversus abdominis muscle flap (TRAM flap، الموضحة في الشكل 39-36). وتقويم الحلمة عملية جديدة نسبيًا يمكن إجراؤها تحت بنج موضعي. ولتحقيق التناظر، يحتاج الثدي المقابل إلى عملية مزوِّقة مثل رأب ثدي تصغيري reduction mammoplasty. ويمكن التوصية ببديل يوضع في الصديرية bra وبعض هذه البدائل موضح في الشكل 39-37.
التقصي Screening
بما أن إنذار سرطان الثدي وثيق الصلة بمرحلته عند
تشخيصه، فقد يبدو من المحتمل أن نتمكن من خفض معدل الوفاة من
سرطان الثدي بتأسيس برامج لتقصِّي المواطنات يستطيع كشف
الأورام قبل أن تلاحظها المريضة. وقد بين عدد من الدراسات
بالفعل أن تقصي الثدي بتصوير ثدي
mammography
النساء فوق سنّ الخمسين يقلل معدل الوفاة المرتبط بسبب خاص
cause specific mortality
بما يقرب من 30 بالمائة. وقد أعدت الخدمات الطبية الوطنية في
المملكة المتحدة، عقب نشر تقرير فوريست*
عام 1987، برنامجًا لتقصي النساء بين سن 50 و64 بتصوير الثدي
كل ثلاث سنوات. ومما لا شك فيه أن وضع هذا البرنامج في موضع
التنفيذ حسَّن نوع الخدمات المقدمة لمعالجة سرطان الثدي، ولكن
يبقى هناك عدد من
تصوير الثدي Mammography. يعتمد التقصي المفضَّل على تصوير الثدي. وأهم ظواهر السرطان التي تشاهد في صورة الثدي هي: · آفة مصمتة حوافـُّها غير واضحة أو شكلُها نجمي. · عدم تناظر asymmetry (بالكثافة أو التوعية vascularity أو الهندسة السَدَوية stromal architecture). · تكلـُّس صغري micocalcification حقيقي. · انفتال الجلد أو حياط الثدي؛ زيادة سماكة الجلد. · قناة متوسعة وحيدة. · آفة كبيرة حياطُها عقيدي nodular outline. · تغيرات في صور الثدي المتسلسلة. والتكلس الصغري الحقيقي ظاهرة خاصة للأورام المبكرة لا تُكشف بالفحص السريري. ودقة الاستقصاء يعتمد على الفاحص observer dependant وقد ذكر أنها تتراوح بين 60 إلى 98 بالمائة. (آزوباردي*). تأثيرات الحمل The effects of pregnancy على سرطان الثدي لم تدرس جيدًا بعد، ولكن يعتقد أن سرطان الثدي الذي يظهر في أثناء الحمل أو الإرضاع ينحو إلى أن يكون في مرحلة متأخرة - وذلك لأنه يفترض أن الحمل يحجب الأعراض - إلا أن السرطان يسلك، من النواحي الأخرى، طريقًا مثل سرطان الثدي في النساء الصغيرات من غير الحاملات، ويجب أن يعالج كذلك. أما إذا حملت المريضة بعد تشخيص سرطان الثدي، فلا يبدو أن ذلك يؤثر في النتيجة النهائية، ولكن النساء ينصحن عادة بأن يتريثن مدة عامين لأن الرجعة تحدث خلال هذا الوقت أكثر ما يمكن. وخطورة حدوث سرطان الثدي بعد استعمال حبوب منع الحمل لا تزداد بالرغم من وجود بعض القلق، لأن استعماله المطوَّل قبل أول حمل تام المدة، قد يعرِّض السيدة إلى خطورة زائدة متوسطة. العلاج الهرموني التعويضي Hormone replacement therapy (HRT) لايبدو أنه يزيد خطورة حدوث سرطان الثدي زيادة ملحوظة إلا إذا أخذ لفترات طويلة (فوق 10 سنين)، وربما في مجموعات معينة مرتفعة الخطورة. أما العواقب بالنسبة للرجعة بعد استعمال العلاج الهرموني التعويضي HRT عقب استئصال سرطان الثدي فإنها ليست معروفة.
معالجة المرض المتقدم Treatment of advanced disease ربما يظهر سرطان الثدي كمرض نقيلي من دون دليل على المرض الأولي (أي مع أولي خفي occult primary). ويوضع التشخيص جزئيًا باستبعاد مواقع أخرى للمرض الأولي، وقد يوثـَّـق بفحص الآفات النقيلية نسيجيًا. ويجب أن توجه المعالجة إلى تلطيف الأعراض ومعالجة سرطان الثدي بمنابلة صمَّاوية endocrine manipulation. إن سرطان الثدي المتقدم موضعيًا locally advanced العصيِّ على الجراحة، بما في ذلك سرطان الثدي الالتهابي، يعالج عادة بعلاج مجموعي - إما بعلاج كيماوي أو علاج هرموني. وفي بعض الأحيان، يتطلب الأمر استئصال ثدي تنظيفي toilet mastectomy أو مداواة بالأشعة للسيطرة على ورم منفطر fungating tumour، ولكن الشقَّ خلال أنسجةٍ توغلَ المرض فيها، غالبًا ما يجعل النتيجة أسوأ. سرطان الثدي النقيلي Metastatic carcinima of the breast يحتاج أيضًا إلى بعض أشكال العلاج المجموعي الملطـِّـف لتخفيف الأعراض. إن المنابلة الهرمونية (بيتسون*) هي الخط الأول غالبًا بسبب تأثيراتها الجانبية الطفيفة. وهي مفيدة بالذات في النقائل العظمية. ومع ذلك، تستجيب حوالي 30 بالمائة من هذه الأورام للهرمونات، وحتى هذه لسوء الحظ، تصبح بمرور الوقت مقاوِمةً لهذه المعالجة. والخط الأول في العلاج الهرموني للنساء بعد الإياس هو التاموكسيفين، وبالنسبة للنساء قبل الإياس هو كبت المبيضين؛ وقد تثبت أدوية هرمونية أخرى فائدتها عند نشأة المقاومة لهذين الخطين، وقد تعادل الاستجابة لها، نصفَ الاستجابة لعلاج الخط الأول. إن البروجيستاجينات progestagens مثل أسيتات ميدروكسي بروجيستيرون (Provera)، أو مثبطات الأروماتيز (المواد العطرية) مثل أمينوجلوتيثامايد aminoglutethamide، أو أدوية جديدة مثل 4-هيدروكسي أندروستنيديون hydroxyandrostenedione ومضاد البروجيستينات antiprogestins ومضادة الاستروجينات antioestrogens الصرفة، كلَّها مرشحة لهذا الدور. ويستعمل العلاج السام للخلايا cytotoxic therapy بشكل خاص في النساء الصغيرات أو أولئك المصابات بنقائل حَشَوية visceral وأورام سريعة النمو. وهناك أنظمة مختلفة متوافرة، وبالرغم من أنها كلـَّها لا تطيل الحياة، بعكس التوقعات، فإن نوعيةَ الحياة والسيطرة على الأعراض أفضلُ في الغالب، إذا كانت المعالجةُ حثيثةً جدًا، إذ تصل الاستجابة التي يتم الحصول عليها في المريضات، إلى 70 بالمائة. وقد يثبت أن المعالجة الموضعية مفيدة أيضًا في بعض أنواع المرض النقيلي، مثل مداواة ترسبات العظم المؤلمة بالأشعة وتثبيت الكسور المرضية تثبيتًا داخليًا. * وليام ستيوارت هولستيد William Stewart Halsted، 1852-1922، استاذ الجراحة، جامعة جونز هوبكينز، بلتيمور. وقد كان وراء تطوير بتر الثدي بترا جذريا كما يتم اجراؤه اليوم. وكثيرا ما تعرف العملية بـ عملية هولستيد التامة complete Halsted. * ديفيد هوارد باتيDavid Howard Patey ، 1899-1976. جراح مستشفى ميدلسيكس، لندن، انجلترا. * سير تشارلز بيلّSir Charles Bell ، 1774-1842. جراح، مستشفى ميدلسيكس، لندن، ومؤسس كليته الطبية. * أومبيرتو فيرونيزي Umberto Veronesi، معاصر. ميلان، ايطاليا. [1] CMF = cyclophosphamide, methotrexate and 5-flourouracil (5FU). * الاستاذ أ. ب. م. فوريست، استاذ كرسي الجراحة الملكي، أدنبرة، سكوتلندا، (1970-1989). * جون جيرالد آزوباردي John Gerald Azzopardi، معاصر. استاذ شرف طب الأورام، كلية طب الدراسات العليا، هامرسميث، لندن، انجلترا. * سير جورج توماس بيتسونSir George Thomas Beatson ، 1848-1933. جراح، ويستيرن انفيرماري، جلاسكو، سكوتلندا.
|